人的肉眼分辨本领在0.1毫米左右,我们是怎么一步步地看见细菌、病毒,乃至蛋白质结构的呢?这背后离不开这群“强迫症”。
撰文/记者 段然 编辑/刘昭
新媒体编辑/李云凤
采访专家
张德添(军事医学科学院国家生物医学分析中心教授)
“我非常惊奇地看到水中有许多极小的活体微生物,它们如此漂亮而动人,有的如长矛穿水而过,有的像陀螺原地打转,还有的灵巧地徘徊前进,成群结队。你简直可以将它们想象成一群飞行的蚊虫。”
1675年,一名荷兰代尔夫特市政厅的小公务员给英国皇家学会写了这样一封信,向学会的会员们描述自己用自制的显微镜观察到的奇妙景象。作为给当时欧洲最富盛名的学术组织寄去的一封学术讨论信件,这名公务员并没有进行大篇幅严谨却枯燥的科学论证,而是用朴实的语言,在字里行间留下了自己发现新事物时那种孩童般的惊奇与喜悦。
这位当时默默无闻的小公务员,正是大名鼎鼎的微生物学和显微镜学先驱者—安东尼·范·列文虎克。在50年的时间里,列文虎克用制作的显微镜观察到了细菌、肌纤维和精细胞等微观生物,并先后给英国皇家学会寄去了300多封信件来讨论他的新发现。正是在列文虎克的不懈坚持下,人类观察世界的眼睛终于来到了微生物层面。
◆ ◆ ◆
初代显微镜:拨开微生物世界的迷雾
列文虎克能发现色彩斑斓的微生物世界,主要得益于他在透镜制作方面的天赋。他一生中制作了多达400多台显微镜,与今日我们熟知的显微镜存在很大不同,列文虎克的显微镜绝大多数属于单透镜显微镜,仅由一个小黄铜板构成,使用时需要仰身将这个铜板面向阳光进行观察。列文虎克凭借他的一系列惊人发现迅速成为当时科学界的“网红级”人物。
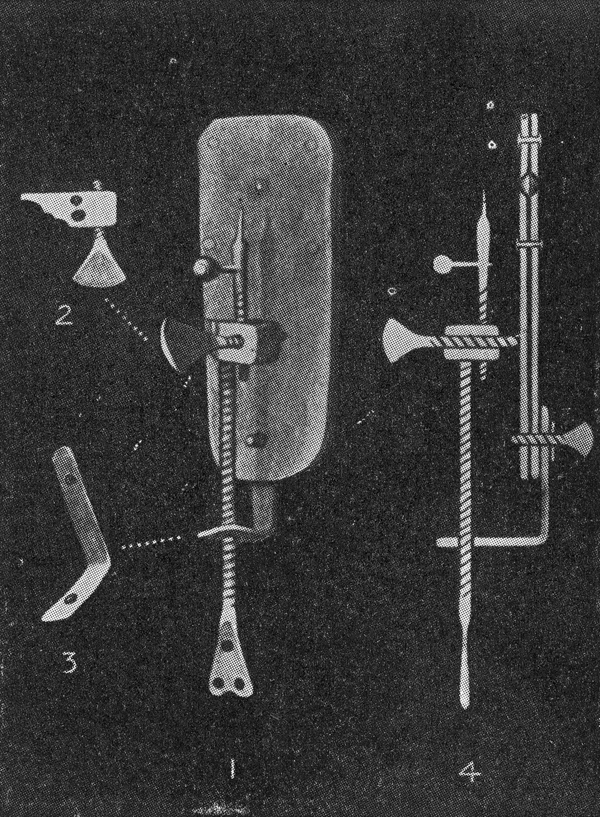
▲列文虎克在17世纪设计的显微镜图(图片来源/视觉中国)
然而真正奠定显微镜学理论基础的,则是同时期的英国科学家罗伯特·胡克。在列文虎克还在钻研透镜制作技艺时的1665年,在英国皇家学会负责科学试验的胡克,就制作了一台显微镜,与列文虎克使用的单透镜显微镜不同,这是一台复式显微镜,其工作原理和外形已经很接近现代的光学显微镜了。
胡克用这台显微镜观察一片软木薄片,发现了密密麻麻的格子状结构,酷似当时僧侣居住的单人房间,因此胡克就用英语中单人间一词“cell”来命名这种结构,而这个单词在当代被翻译为“细胞”。不久,胡克写就了《显微图谱》一书,将这一重要观察成果写入书中。
胡克的研究成果很快引起了列文虎克的注意,他曾研究过胡克的显微镜,但最后还是使用了自制的单透镜显微镜来进行观察。原因就在于胡克显微镜存在严重的色差问题。所谓色差,就是在光线经过透镜时,不同颜色的光因折射率不同,会聚焦于不同的点上,使得样品的成像被一层色彩光斑所包围,严重影响清晰度。
列文虎克提出的解决方案也很简单,就是在透镜研磨的精细程度上下功夫,将单透镜制成小玻璃珠,并将之嵌入黄铜板的细孔内,这样在放大倍数不低于胡克显微镜的基础上,最大程度避免色差对成像的干扰。但代价是,由于观察时是需要对着阳光,对观测者的眼睛伤害很大。
除了色差,早期显微镜还存在着球面像差问题,即光线在经过透镜折射时,接近中心与靠近边缘的光线不能将影像聚集在一点上,使得成像模糊不清。自显微镜诞生之日起,色差和球面像差就成为“与生俱来的顽疾”,一直制约着人们向微观世界进军的步伐。直到19世纪,光学显微技术才在工业革命的助力下完成了一次实质性蜕变,从而在根本上解决了这两个难题。
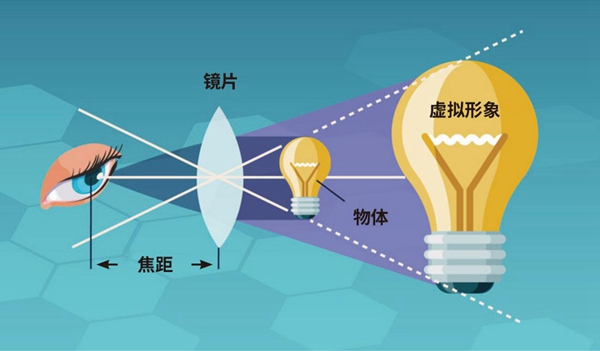
▲利用单个透镜放大物体影像(图片来源/Technology Networks)
◆ ◆ ◆
挑战色差与球面像差:逐渐清晰的微观视角
首先是1830年,一个名为李斯特的英国业余显微镜学爱好者首先向球面像差发起挑战,他创造性地用几个特定间距的透镜组,成功减小了球面像差影响。
此后,改进显微镜的主阵地很快转移到了德国,其中1846年成立的蔡司光学工厂,更是在此后一个世纪里成为领头羊。1857年蔡司工厂研制出第一台现代复式显微镜,并成功打入市场。不过在研制和生产过程中,蔡司也深受色差之苦:当时通行的增加透镜数量的做法,虽能提升显微镜的放大倍数,却仍无法消除色差对成像清晰度的干扰。
1872年,德国耶拿大学的恩斯特·阿贝教授提出了完善的显微镜学理论,详细说明了光学显微镜的成像原理、数值孔径等科学问题。蔡司也迅速邀请阿贝教授加盟,并研制出一批划时代的光学部件,其中就包括复消色差透镜,一举消除了色差的影响。
在阿贝教授的技术加持下,蔡司工厂的显微镜成为同类产品中的佼佼者,很快成为欧美各大实验室的抢手货,并奠定了现代光学显微镜的基本形态。不久,蔡司又拉来了著名化学家奥托·肖特入伙,将其研制的具有全新光学特性的锂玻璃应用在自家产品上。1884年,蔡司更是联合阿贝与肖特,成立了“耶拿玻璃厂”,专为显微镜生产专业透镜。

▲1862年生产的复合显微镜(摄影/Manfred Stich)
显微镜技术的突飞猛进也让各种现代生物学理论不断完善,透过高分辨率的透镜,微观世界中各种复杂的结构逐步以具象的形式呈现在人类眼前。
由于微观层面的生物结构大多是无色透明的,为了让他们在镜头下变得清晰可见,当时的科学家普遍将生物样品染色,以此提高对比度方便观察。这一方法最大的局限在于,染料本身的毒性往往会破坏微生物的组织结构,这一时期染剂落后的材质,也无法实现对某些特定组织的染色。
直到1935年荷兰学者泽尼克发现了相衬原理,并将之成功应有于显微镜上。这种相衬显微技术,利用光线穿过透明物体产生的极细微的相位差来成像,使得显微镜能够清晰地观察到无色透明的生物样品。泽尼克本人则凭借此次发现斩获了1953年的诺贝尔物理学奖。
军事医学科学院国家生物医学分析中心教授,长期致力于电子显微镜领域研究的张德添向记者介绍道:“人的肉眼分辨本领在0.1毫米左右,而光学显微镜的分辨本领可以达到0.2微米(1毫米=1000微米)的水平,能够看到细菌和细胞。但由于光具有波动性,衍射现象限制了光学显微镜分辨本领的进一步提高。”
二战结束后,随着各种新理论新技术的不断应用,光学显微镜得到了长足进步,但也是在这一时期,光学显微镜的潜力已经被发掘到了极限。为蔡司工厂乃至整个显微镜学立下汗马功劳的阿贝教授就提出了“分辨率极限理论”,认为普通光学显微镜的分辨率极限是0.2微米,再小的物体就无能为力了—这一理论又被称为“阿贝极限”,这就好像一层屏障将人类的探索目光阻隔在更深度的微观世界大门之前,迫使科学家们另寻他途。
◆ ◆ ◆
电子显微镜:另辟蹊径,重新发现
既然可见光存在这样的短板,那么能否利用其他波长较短的光束来实现分辨率的突破呢?张德添进一步介绍道:“1924年后,人们从物质领域内找到了波长更短的媒质—电子,从而发明了电子显微镜,其分辨本领达到了0.1纳米的水平。”
1931年,德国科学家克诺尔和他的学生鲁斯卡在一台高压示波器上加装了一个放电电子源和三个电子透镜,制成了世界首台电子显微镜,就此为人类探索微观世界开拓了一条全新的思路。

▲鲁斯卡1933年研制的透射电子显微镜(图片来源/Wikimedia Commons)
电子显微镜完全不受阿贝极限的桎梏,在分辨率上要远远超越当时的光学显微镜。鲁斯卡在次年对电子显微镜进行了改进,分辨率一举达到纳米级别(1微米=1000纳米)。在这个观测深度,人类终于亲眼看到了比细菌还要小的微生物—病毒。1938年,鲁斯卡用电子显微镜看到了烟草花叶病毒的真身,而此时距离病毒被证实存在已经过去了40年时间。
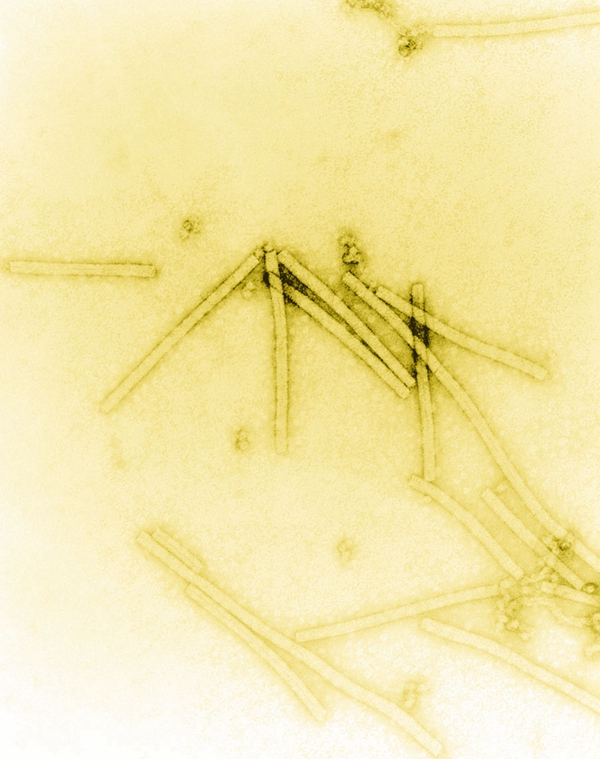
▲透射电子显微镜下的烟草花叶病毒(图片来源/The Nobel Prize)
对于电子显微镜技术的发明,张德添这样评价道:“电子显微镜是人们认识超微观世界的钥匙和工具,它解决了光学显微镜受自然光波长限制的问题,将人们对世界的认识从细胞水平提高到了分子水平。” 从肉眼只能观察到的毫米尺度,到光学显微镜能够达到的微米尺度,再到电子显微镜能进一步下探到纳米尺度,显微成像技术正在迅速突破人类对微观世界的认知极限。
不过电子显微镜本身的缺憾也愈加明显。由于电子加速只能在真空条件下实现,在真空环境之下,生物样品往往要经过脱水与干燥,这意味着电子显微镜根本无法观测到活体状态下的生物样品,此外电子束本身又容易破坏样品表面的生物分子结构,这就导致样品本身会丢失很多关键信息。这一顽疾在此后又困扰了科学家多年。
直到1981年,IBM苏黎世实验室的两位研究员宾尼希与罗雷尔,用一种当时看起来颇有些“离经叛道”的方法,首先解决了电子束损害样品结构的问题。他们利用量子物理学中的“隧道效应”,制作了一台扫描隧道显微镜。
与传统的光学和电子显微镜不同,这种显微镜连镜头都没有。在工作时,用一根探针接近样品,并在两者之间施加电压,当探针距离样品只有纳米级时就会产生隧道效应—电子从这细微的缝隙中穿过,形成微弱的电流,这股电流会随着探针与样品距离的变化而变化,通过测量电流的变化人们就能间接得到样品的大致形状。由于全程没有电子束参与,扫描隧道显微镜从根本上避免了加速电子对生物样品表面的破坏。
扫描隧道显微镜在今天也被称为“原子力显微镜”,“在微米甚至纳米水平,动态观察生物样品表面形貌结构的变化规律,原子力显微镜是有其独特优势的”,张德添向记者解释说,“如果条件允许,还可以检测生物大分子间相互作用力的大小,为结构与功能关系研究提供便利。”
1986年,宾尼希和罗雷尔凭借扫描隧道显微镜,获得当年的诺贝尔物理学奖,有趣的是,与他们一起分享荣誉的,还有当初发明电子显微镜的鲁斯卡,当时的他已是耄耋老人,而他的恩师克诺尔也早已作古。新老两代电子显微镜技术的里程碑人物同台领奖,成为当时物理学界的一段佳话。

▲1981年,宾尼希和罗雷尔开发了扫描隧道显微镜。五年后,他们获得了诺贝尔物理学奖(图片来源/The Nobel Prize)
◆ ◆ ◆
老树新芽:突破“阿贝极限”的光学显微镜
电子显微镜在问世之后的几十年间,极大拓展了人类对生物、化学、材料和物理等领域认知疆界。而无论是鲁斯卡,还是宾尼希和罗雷尔,他们所作的贡献不仅让自己享誉世界,还助力其他领域的学者登上荣誉之巅。
比如英国化学家艾伦·克鲁格凭借对核酸与蛋白复杂体系的研究获得1982年度诺贝尔化学奖,而他的科研成果正式依靠高分辨电子显微镜技术和X光衍射分析技术而取得的。在克鲁格获奖的当年,以色列化学家达尼埃尔·谢赫特曼更是使用一台电子显微镜,发现了准晶体的存在,并独享了2011年的诺贝尔化学奖。
目前,电子显微镜已经成为金属、半导体和超导体领域研究的主力军。但在生物和医学领域,电子显微镜本身对生物样品的损害,依旧是难以逾越的技术难题。于是不少科学家开始从两条路径上寻求解决之道:
一条是研发冷冻电镜技术,这种技术并不改变电子显微镜整体的工作模式,而是从生物样品本身入手,对其进行超低温冷冻处理。这样状态下,即使处在真空环境中,样品也能保持原有的形态特征与生物活性。“由于观测温度低,生物样品也处于含水状态,分子也处于天然状态,样品对辐射的耐受能力得以提高。我们可以将样品冻结在不同状态,观测分子结构的变化。”张德添向记者解释道。
瑞士物理学家雅克·杜波切特、美国生物学家乔基姆·弗兰克和英国生物学家理查德·亨德森凭借这项技术分享了2017年度诺贝尔化学奖。新冠疫情暴发后,冷冻电镜技术又为人类研究和抗击疫情做出了突出贡献。2020年,西湖大学周强实验室就利用这种技术,首次成功解析了此次新冠病毒的受体—ACE2的全长结构,让人类对新冠病毒的认识向前迈出了关键性一步。
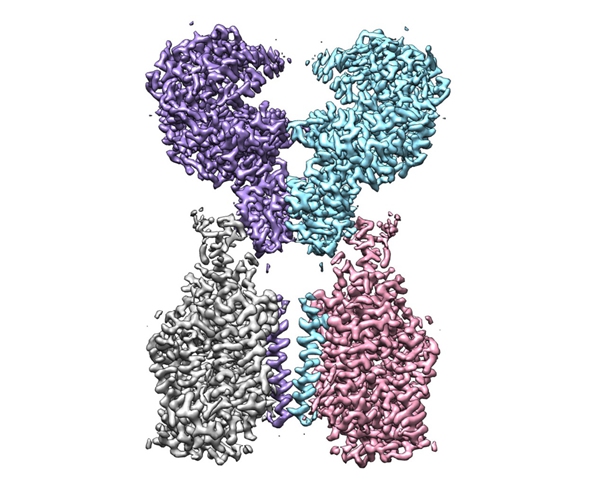
▲ACE2-B0AT1 复合物的冷冻电镜密度图(图片来源/biorxiv)
另一条路径是从传统的光学显微镜入手。在电子显微镜的黄金时代,不少科学家就开始着手研制超高分辨率光学显微镜,甚至开始尝试突破一直以来困扰光学显微镜的“阿贝极限”,而“荧光技术”就成为实现这一切的关键。
早在19世纪中叶,科学家们就发现:某些物质在吸收波长较短而能量较高的光线(比如紫外光)时,能将光源转化为波长较长的可见光。这种现象后来被定义为“荧光现象”。
荧光现象在自然界是普遍存在的,这一现象背后的原理也在20世纪迅速被应用在光学显微镜上。1911年,德国科学家首次研制出荧光显微镜装置,用荧光色素对样品进行荧光染色处理,并以紫外光激发样品的荧光物质发光,但成像效果不佳,而且把荧光物质当作染色剂,和早期的染色剂一样,本身的毒性会伤害活体样品。
直到1974年,日本科学家下村修发现了绿色荧光蛋白,其毒性远弱于以往的荧光物质,是对活体标本进行荧光标记的理想材料——这一发现成为日后科学家突破“阿贝极限”的有力武器。
时间来到1989年,供职于美国IBM研究中心的科学家莫尔纳首次进行了单分子荧光检测,使得光学显微镜的检测尺度精确到纳米量级成为可能。随后在莫尔纳的基础上,美国科学家贝齐格开发出一套新的显微成像方法:控制样品内的荧光分子,让少量分子发光,借此确定分子中心和每个分子的位置,通过多次观察呈现出纳米尺度的图像。通过这种方法,贝齐格轻而易举地突破了光学显微镜的阿贝极限。
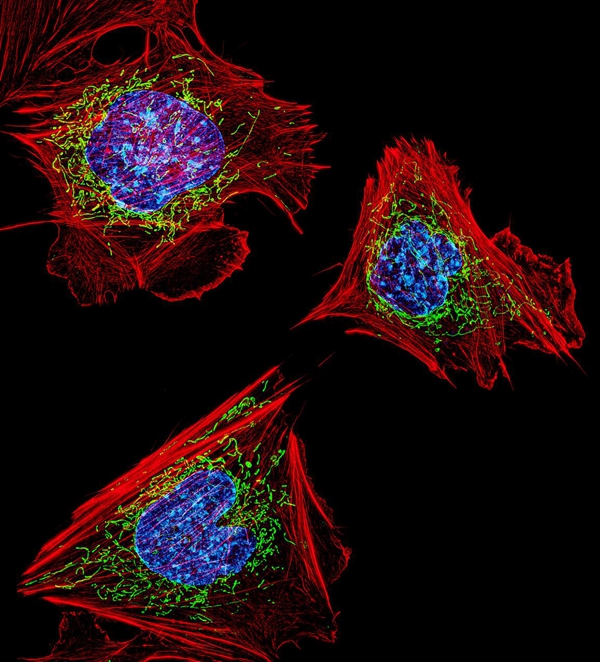
▲通过光激活定位显微镜(PALM)原型显示的成纤维细胞,它是哺乳动物结缔组织中最常见的细胞之一。细胞核(蓝色)、线粒体(绿色)和细胞骨架(红色)内的 DNA 清晰可见(图片来源/NIH)
几乎在同时,德国科学家斯特凡·赫尔在一次光学研究中突发奇想:根据荧光现象原理,如果用镭射光激发样品内的荧光物质发光,同时用另一束镭射光消除样品体内较大物体的荧光,这样就只剩下纳米尺度的分子发射荧光并被探测到,不就能在理论上得到分辨率大于0.2微米的微观成像了吗?
他随即开始了试验,并制成了一台全新显微镜,将光学显微镜分辨率下探到了0.1微米的水平。困扰光学显微技术百年的阿贝极限难题,就这样历经几代科学家的呕心沥血,终于在本世纪初被成功攻克。莫尔纳、贝齐格和赫尔三位科学家更是凭借“超分辨率荧光显微技术”分享了2014年度的诺贝尔化学奖。
时至今日,在探索微观世界的征途上,光学显微镜和电子显微镜互有长短、相得益彰。当然在实际应用中,科学家越来越依赖于将多种显微成像技术结合使用。比如今年5月,英国弗朗西斯·克里克研究所就依托钙化成像技术、体积电子显微技术等多种显微成像技术,成功获得了人类大脑神经网络亚细胞图谱。在未来,多种显微成像技术相结合,各施所长,将进一步完善我们在生物、医学、化学和材料等领域的知识结构,把这个包罗万象的奇妙世界更完整地呈现在我们眼前。■






 2022-06-22
2022-06-22


 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国