2014年,风靡全球的“冰桶挑战”让渐冻症这种罕见病走进了大众的视野,一时引发了大量的社会关注。
今天是国际第22个“渐冻人日”。在这个特殊的日子里,让我们再一次关注渐冻症,关注渐冻人们被冻住的人生。

图1 冰桶挑战
来源:来自Charles Krupa/AP
什么是渐冻症?
渐冻症的学名为“肌萎缩侧索硬化症”,是一种罕见的运动神经元疾病。运动神经元可以把大脑的指令传达给肌肉,控制身体做出各种动作。
而患上渐冻症的人则表现为身体逐渐被“冻僵”,无法动弹。更残忍的是,病人的认知能力并不受影响,这意味着“渐冻人”们会在清醒状态下眼睁睁看着自己被“冻”住——不能行走、不能说话、不能吞咽,直至不能呼吸。
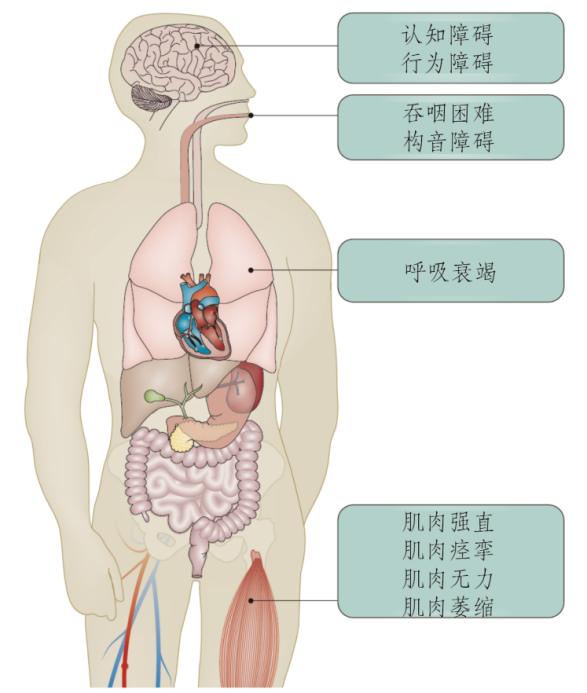
图2 渐冻症的临床表现
来源:参考文献[1]
渐冻症的治疗现状是怎样的?
目前渐冻症几乎仍处于“无药可医”的状态,世界卫生组织将其认定为“五大绝症之一”。
在开发渐冻症治疗药物的漫长岁月中,虽然有50多种药物可延长动物模型的寿命,但在临床上,还没有治疗方法可以逆转渐冻症的发展。
利鲁唑(Riluzole)和依达拉奉 (Edaravone)是目前仅有的两种明确具有干预疾病进程能力的药物。
利鲁唑主要通过抑制脑内神经递质的释放发挥神经保护作用,但仅在治疗前6个月有效,而且也只能将生存期延长2~3个月。依达拉奉是一种自由基清除剂,通过减少氧化应激发挥作用,对早期发病和疾病快速进展的患者有益,但是否能够延长生存期仍不清楚。
在没有特效药的困境下,渐冻症患者只好通过其他手段来延缓身体各功能的衰竭。
比如,患者需要特别关注呼吸道和消化道的功能,并开展有效的康复活动,保护肌肉和关节的活动度以及活动能力,尽量维持身体活动现状。
同时也要特别注意患者的心理健康,及时进行心理疏导。这些支持治疗手段在提高患者的生活质量方面发挥着重要作用,甚至可以延长患者的生存期。
正在路上的渐冻症新疗法
最近,随着生物技术的不断发展,细胞治疗和基因治疗正在给“渐冻人”们带来希望。
细胞治疗,又称细胞移植治疗,指的是将正常或者生物工程改造过的人体细胞移植到患者体内,替代原有的受损细胞,或者通过分泌因子发挥生物功能,从而达到治疗疾病的目的。
对渐冻症患者来讲,他们的大脑处在炎性环境中,而移植的干细胞则可以分泌各种神经营养因子,为运动神经元提供营养支持,减缓病变。
目前间充质干细胞和神经干细胞的应用最为广泛。如2017年在以色列开展了一项临床试验,研究人员通过肌肉和鞘内联合移植将间充质干细胞移植到了渐冻症患者体内。
结果表明,14位受试者耐受良好,用力肺活量的恶化速度减缓,渐冻症的功能评分下降减慢(图3),治疗后6个月病程进展至少改善了25%,显示了细胞移植在治疗渐冻症时的巨大潜力。
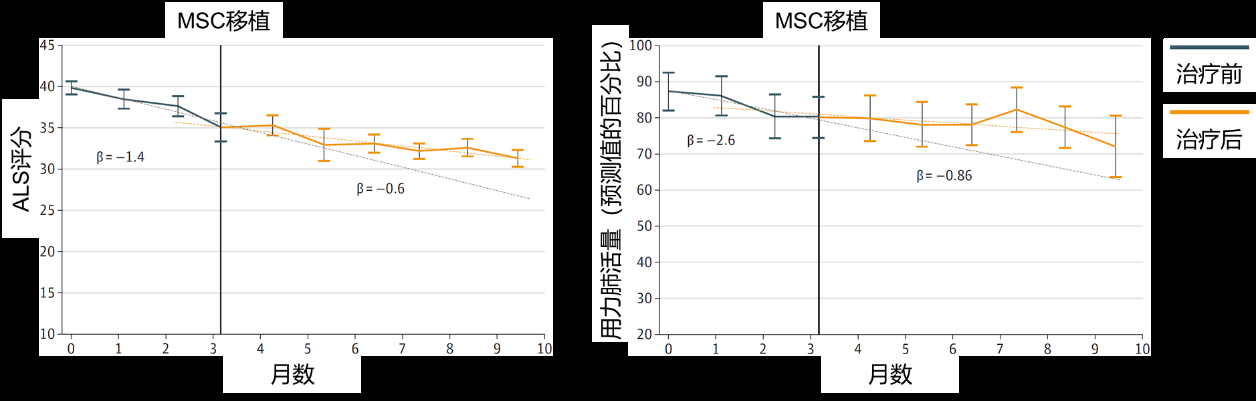
图3 间充质干细胞移植对渐冻症的治疗效果
来源:参考文献[2]
新兴的基因疗法也是一种非常有潜力的治疗方式,主要的策略包括反义寡核苷酸(ASOs)、RNA干扰(RNAi)、基因编辑、腺相关病毒(AAV)介导的基因递送等。
ASOs和RNAi都是通过靶向信使RNA介导其降解,进而降低靶基因的表达来发挥作用。这两种策略主要针对家族性渐冻症,这类渐冻症具有明确的突变基因,如SOD1、C9ORF72等。原理上讲,只要将突变的基因“消除”,渐冻人的症状就会有所缓解,甚至完全恢复。
根据最新成果来看,Biogen(渤健)公司开发了针对SOD1的ASO药物Tofersen,临床I/II试验表明,Tofersen 可降低脑脊液中SOD1蛋白的浓度(图4)。
2021年10月17日,该公司公布了Tofersen的关键III期临床试验研究结果。结果显示,虽然没有达到研究主要终点,但在生物活性和临床功能的多项次要和探索性指标中看到了有利于Tofersen的趋势,并且较早开始治疗的受试者获得了更好的治疗效果。
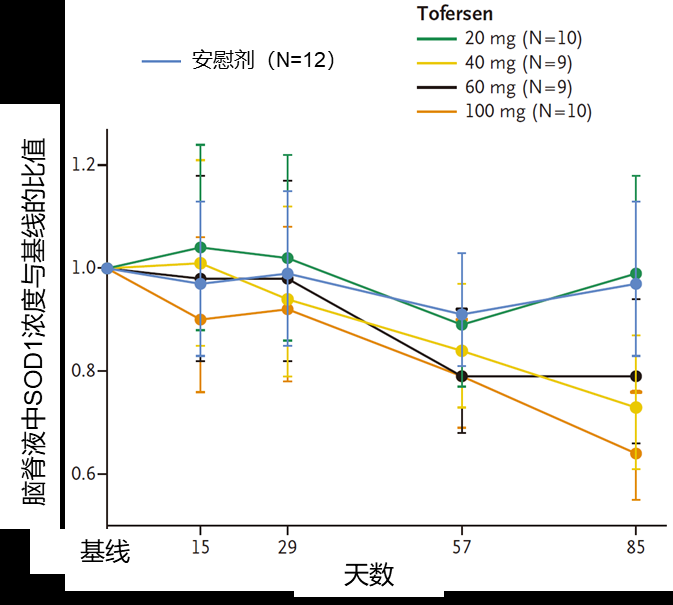
图4 Tofersen可降低渐冻症患者脑脊液中的SOD1蛋白
来源:参考文献[3]
在利用RNAi策略治疗渐冻症方面,2020年7月,《新英格兰医学杂志》发表了一项通过鞘内注射由AAV装载的靶向SOD1的小RNA(rAAVRh10.mi-SOD1)来治疗渐冻症的报道,研究表明,注射后脊髓内SOD1蛋白表达下降,其中1例患者的渐冻症功能评分维持稳定,未见恶化趋势(图5),这表明鞘内注射小RNA可作为家族性渐冻症的潜在治疗手段。
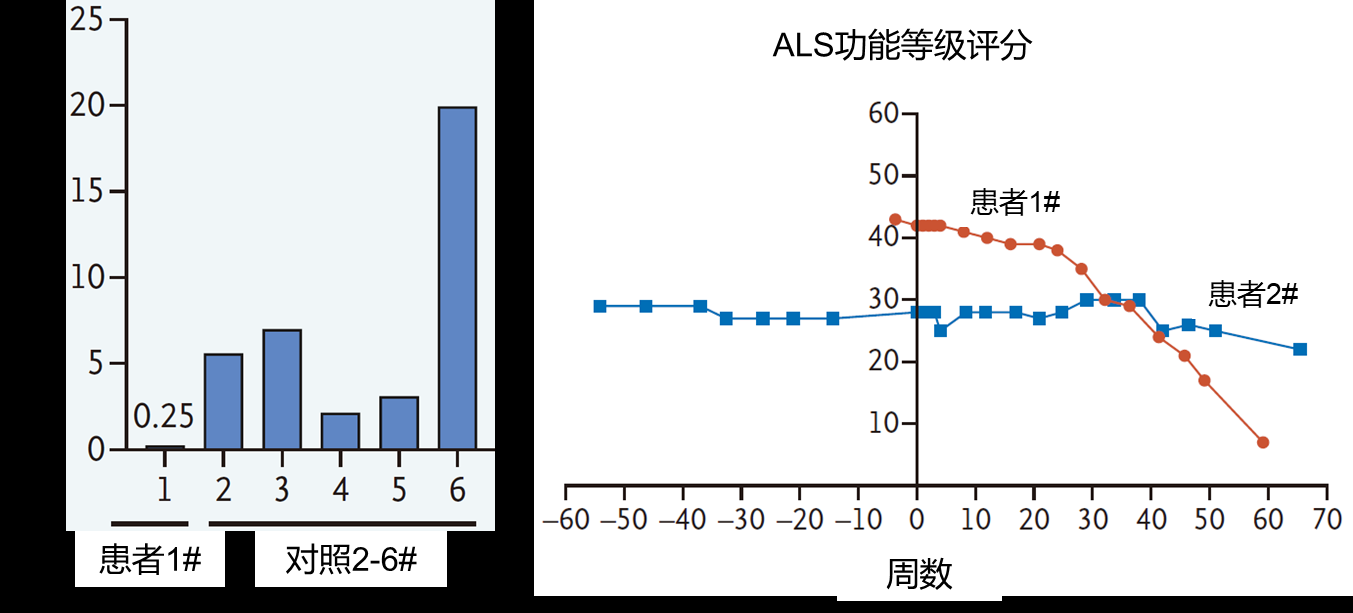
图5 rAAVRh10.mi-SOD1治疗SOD1突变渐冻症患者的结果
来源:参考文献[4]
此外,基因编辑在治疗渐冻症的进程中也无法被忽视。其中基因剪刀CRISPR-Cas系统的发现赋予了人们精准编辑基因组的能力,它可以靶向特定的基因组序列,诱导DNA双链的断裂,进而破坏基因的表达。
2017年《科学进展》杂志发表了第一项针对渐冻症的基因编辑研究,研究人员将靶向SOD1的CRISPR-Cas工具通过静脉注射递送至新生的渐冻症模型小鼠,成功将SOD1蛋白水平降低了2.5倍。
经治疗的小鼠运动神经元得到保存,运动功能得到改善,发病时间延迟37%,生存率提高25%(图6)。
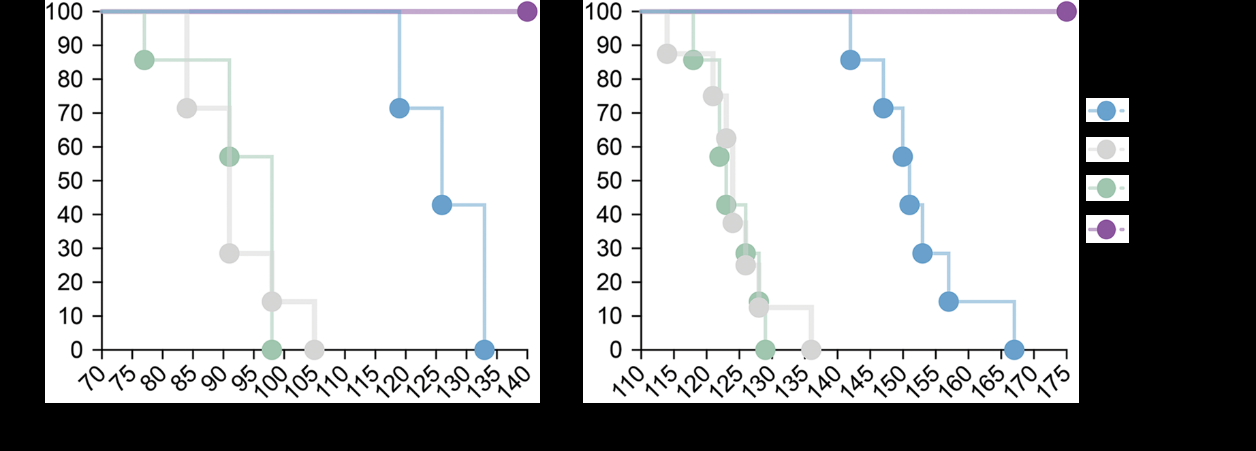
图6 针对SOD1的基因编辑延迟了渐冻症小鼠发病,并提高了生存率
来源:参考文献[5]
除了上述几种治疗方式外,科学家们也尝试着使用各种载体,如AAV或脂质纳米颗粒递送神经营养因子,为退化的神经元提供营养支持。
虽然这些方法是非特异性的,不太可能治愈渐冻症,但有可能延长渐冻症患者的生存时间,因此具有一定的应用前景。
新技术助力渐冻人“说话”
除了关注渐冻症患者的生存能力外,科学家们也十分关注他们的生活质量,对于难以改善病症的晚期渐冻人们,科学家们也正在努力提升他们与外界的交流沟通能力。
著名的物理学家霍金通过一款语音表达系统实现与他人的交流,该系统通过捕获眼球和面部的肌肉运动来将霍金的想法翻译成单词。
如今,重度的渐冻症患者又多了一个新选择,今年3月22日发表在《自然通讯》上的文章报道了一种新技术——脑机接口(Brain Computer Interface, BCI),它可以读取大脑信号,并通过机器上的字母选择组合实现句子的完整表达[6]。
一位来自德国的36岁男性渐冻症患者利用BCI成功表达了对儿子的爱。这让我们看到,BCI正在帮助晚期完全封闭的渐冻人们重拾与外界沟通的能力。

图7 患者通过BCI系统实现想法的即时表达
来源:Wyss生物和神经工程中心
渐冻症虽然可怕,但科学家们正在解救“渐冻人”们的路上。我们期待将来能有更加深入、详尽的科学研究,能够不断完善渐冻症的治疗方案,早日解冻“渐冻人”们被冻住的人生。
编辑|王婷婷
参考文献:
1. Hardiman, O., et al., Amyotrophic lateral sclerosis. Nat Rev Dis Primers, 2017. 3: p. 17071.
2. Petrou, P., et al., Safety and Clinical Effects of Mesenchymal Stem Cells Secreting Neurotrophic Factor Transplantation in Patients With Amyotrophic Lateral Sclerosis: Results of Phase 1/2 and 2a Clinical Trials. JAMA Neurol, 2016. 73(3): p. 337-44.
3. Miller, T., et al., Phase 1-2 Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS. N Engl J Med, 2020. 383(2): p. 109-119.
4. Mueller, C., et al., SOD1 Suppression with Adeno-Associated Virus and MicroRNA in Familial ALS. N Engl J Med, 2020. 383(2): p. 151-158.
5. Gaj, T., et al., In vivo genome editing improves motor function and extends survival in a mouse model of ALS. Sci Adv, 2017. 3(12): p. eaar3952.
6. Chaudhary, U., et al., Spelling interface using intracortical signals in a completely locked-in patient enabled via auditory neurofeedback training. Nat Commun, 2022. 13(1): p. 1236.
(注:文中拉丁文名应为斜体)

出品:科普中国
作者:李玉欢(吉林大学)
监制:中国科普博览







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国