随着ddcfDNA进入移植临床应用阶段,需要对检测值的临床意义进行正确的解读,一方面要求我们了解在不同病理状态下ddcfDNA的变化模式特征,另一方面还需要了解非病理因素等对ddcfDNA检测值的影响。本届ATC会议共有13篇代表性研究聚焦于“ddcfDNA检测值影响因素”主题方向,接下来我们将总结为三部分进行详细解读。
供/受体人口学特征、不同供体类型及术前诱导方案对术后早期ddcfDNA值有何影响?
奥古斯塔大学医学中心(Augusta University Medical Center, Augusta, GA)发现,多器官联合移植和男性供体会导致移植术后1个月内较高的ddcfDNA值。通过对101例肾移植患者术后1个月ddcfDNA检测,发现胰肾联合移植(kidney-pancreas dual transplant)的ddcfDNA中位值显著高于单肾移植(1.5% vs 0.4%,n=3 vs 98,p < 0.05)(图1a)。男性供体的受者ddcfDNA中位值显著高于女性供体(0.575% vs 0.28%,n= 62 vs 38,p < 0.01)(图1b)。

图 1
而在心脏移植中,贝勒大学医疗中心(Baylor University Medical Center, Dallas, TX,)A. Alam教授团队的研究发现,供/受体的性别/种族因素对术后3个月的ddcfDNA值并没有显著影响(图2)。研究入组了609例术后一年内稳定的心脏移植患者(并非所有供/受者特征均纳入分析),其中189例在术后3个月内有ddcfDNA检测结果,中位值为0.053%(IQR:0.028-0.098)。

图2
在分析年龄因素时,未发现ddcfDNA值与受体年龄显著相关,即使在高龄受体组(51-70岁),ddcfDNA值仍相对较低(0.047%,IQR:0.029-0.083)。但ddcfDNA值与供体年龄有微弱相关性,且有统计学意义(Pearson's r:0.178,p = 0.014)(图3)。

图3
在多重因素(性别、年龄及种族)模型中,未发现协同因素显著影响术后3个月的ddcfDNA值,且整体预测能力很差(R2 = 0.059)。
该研究认为供/受体人口学特征(性别、年龄及种族)与心脏移植术后3个月的ddcfDNA值无显著相关,提示移植术后早期ddcfDNA显著升高可解读为由特异性免疫损伤造成。
同样,来自哥伦比亚大学欧文医学中心(Columbia University Irving Medical Center, New York)的研究数据也表明,性别对于心脏移植受者的ddcfDNA值无显著影响,ddcfDNA检测值无需针对性别进行特异性解读。
研究共入组了2029例受者(544例女性,26.8%),其中67.7%为白人,平均年龄为56.7岁。有8.5%受者为丙肝阳性供体,58.1%的女性和53.5%的男性感染过CMV。56.1%的女性受者的供体为女性,只有24.5%男性受者的供体为女性。
稳定状态下的男性和女性受者的ddcfDNA中位值无显著差异(p=0.133)(图4)。有132例(23.7%女性)受者发生排斥(49例AMR,77例ACR,6例ACR合并AMR),在确诊排斥前的90天内,ddcfDNA值在不同性别中(106个样本)也无显著差异(图5)。
在中位357天的随访中,对于由排斥、dnDSA、CAV或LVEF下降等因素影响的结果中,ddcfDNA值在不同性别间无显著差异(85例女性,17.7%;260例男性,15.9%;log-rank p = 0.36)。
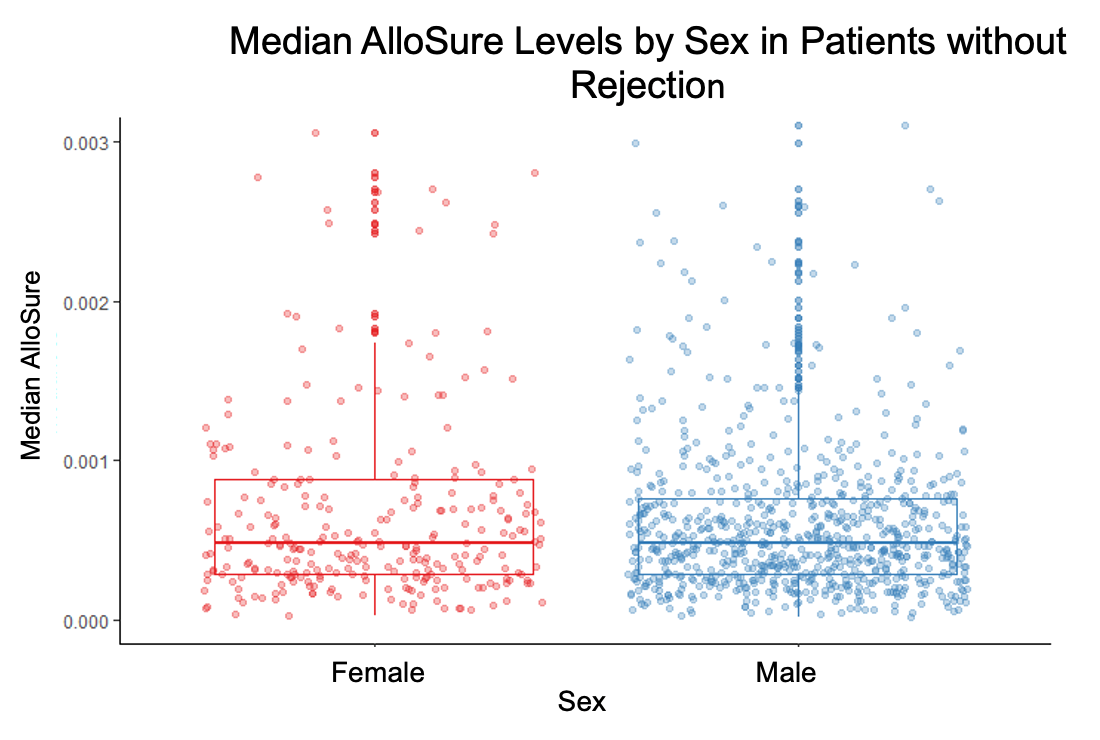 图4
图4
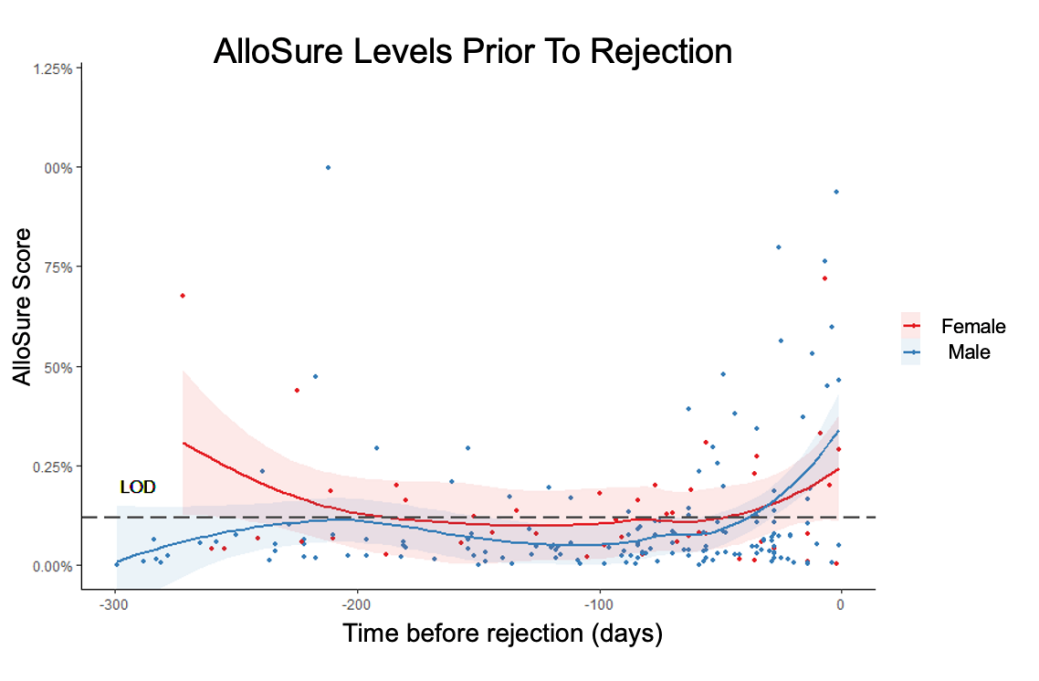 图5
图5
而在种族差异对ddcfDNA检测值影响方面,有研究表明移植术后稳定状态下,非裔美国人(AA)受者的ddcfDNA值高于非非裔美国人(非AA)。来自拉什大学医学中心(Rush University Medical Center, Chicago, IL)的研究者,进一步分析了AA与非AA受者在发生排斥时ddcfDNA值的差异。
研究入组了40例肾移植受者(19例AA,21例非AA),共55个活检结果(27个AA,28个非AA)。28个发生排斥(15个AA,13个非AA),27个未发生排斥(12AA,15非AA)。排斥组ddcfDNA中位值为1.45%(IQR 0.53%-2.5%),AA排斥组中位值为1.30%(IQR 0.38-1.8%),非AA排斥组中位值为2.3%(IQR 0.89-4.4%)。非排斥组ddcfDNA中位值为0.24%(IQR 0.15-0.47%),AA非排斥组中位值为0.2%(IQR 0.15-0.67%)(图6)。整个队列的排斥反应受试者工作曲线(ROC)分析的曲线下面积(AUC)为0.84(95% CI = 0.74-0.95),单独AA组AUC为0.74(95% CI =0.54-0.95),非AA组AUC为0.95(95% CI = 0.88-1.00)(图7)。
值得注意的是,在发生排斥的受者中,33%(n=5:3个ACR,1个AMR,1个mixed)的AA受者ddcfDNA<0.5%,而非AA受者仅有0.08%(n=1,AMR)的ddcfDNA<0.5%。这表明AA受者和非AA受者在同样的低水平ddcfDNA时,AA受者可能已经发生排斥。此差异的可靠性需要进一步研究。
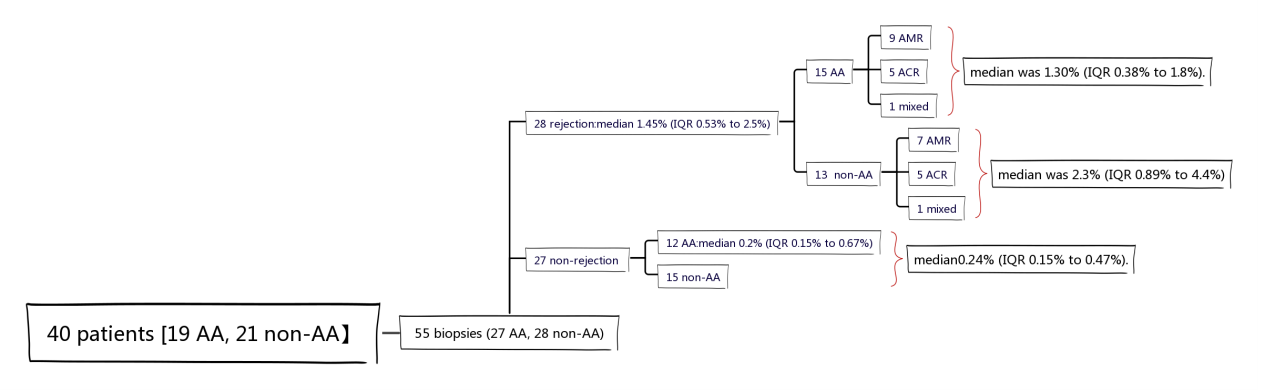 图6
图6
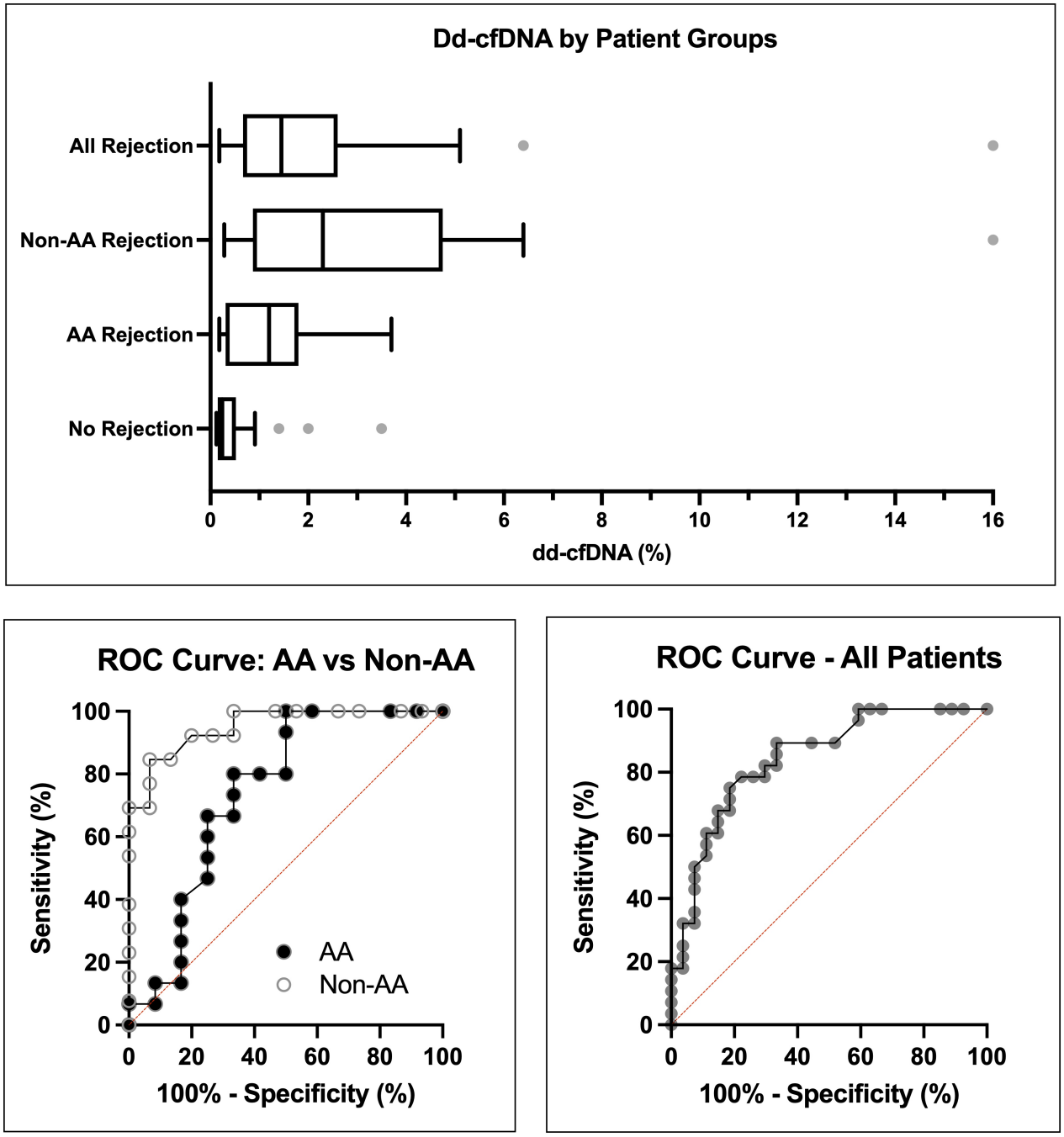 图7
图7
除了供/受体人口学特征的研究,在不同供体类型、冷缺血时间(CIT)及不同免疫诱导方案对术后早期ddcfDNA检测值的影响方面也有研究报道。阿勒格尼综合医院肾脏病科(Nephrology, Medicine Institute, Allegheny General Hospital, Pittsburgh)对移植术后8周左右进行ddcfDNA检测的111例肾移植受者(包括ddcfDNA<1.0%的受者)进行了回顾性研究。其中39例LDRT供肾,55例DBD供肾,17例DCD供肾;63例CIT <12 小时,46例CIT ≥12 小时,有2例CIT数据缺失;101 例使用ATG,10例使用巴利昔单抗。研究发现,ddcfDNA检测值在不同供体类型、CIT时间以及不同免疫诱导方案中无显著差异(图8)。
 图8
图8
术后早期缺血再灌注损伤(IRI),包括由其引起的急性肾小管损伤/坏死(ATI/ATN),作为术后常见的非排斥类型损伤,已有研究表明IRI会引起ddcfDNA值的升高,那么它在不同类型受者中的升高趋势是否有差异?本次ATC有5篇研究聚焦于此方向。
已有研究表明,成人肾移植受者术后ddcfDNA呈L型下降趋势。来自华盛顿大学医学院圣路易斯儿童医院(Pediatrics, Washington University School of Medicine in St. Louis, St. Louis, MO)的研究,探索了儿童肾移植受者中ddcfDNA检测值在术后早期的变化规律。结果显示,儿童肾移植受者术后ddcfDNA值动力学与成人不同,儿童受者的ddcfDNA值在术后较长时间内都处在较高水平。
通过对71例儿童受者的ddcfDNA动态监测(术后30天~1年),筛选了54例稳定受者的204个样本,排除了重大感染、排斥反应及移植肾功能延迟等样本。在该队列中,移植术后30天的ddcfDNA 中位值为0.84(0.64-1.2)%,到第2个月时降至0.43%(0.25-0.66)%,到第6个月时降至0.23(0.16-0.32)%。根据受者年龄(>10岁、<10岁)进一步分组时,与>10岁组(137个样本)相比,<10岁组(67个样本)在移植术后第一年的ddcfDNA均值显著变高。<10岁组的ddcfDNA中位值在移植术后12个月降至0.2%以下,而>10岁组的ddcfDNA中位值在术后4个月内就降至0.2%以下(图9)。
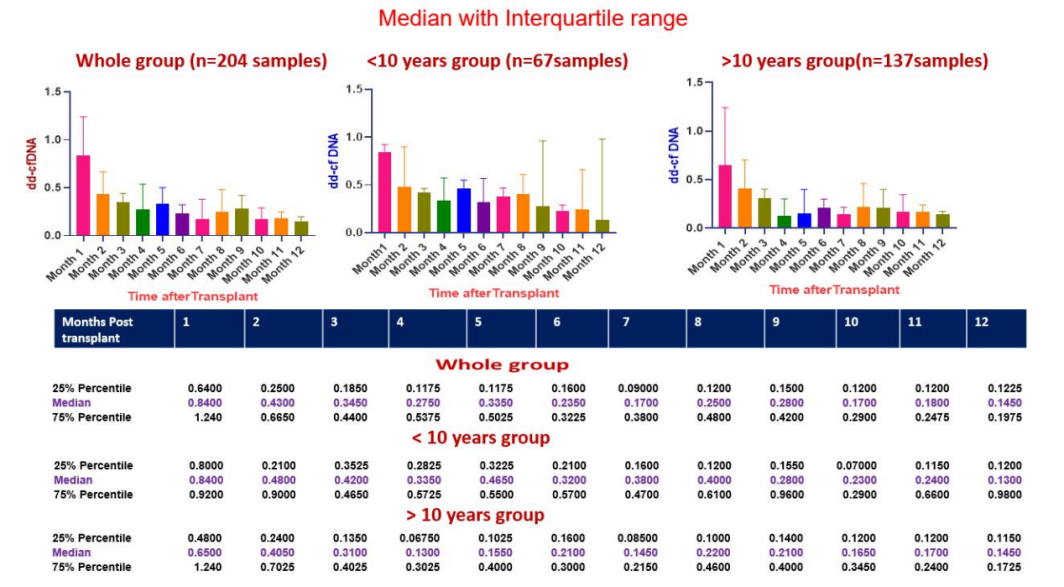 图9
图9
沃思堡医学城移植研究所(Medical City Transplant Institute, Fort Worth)的研究认为术后早期的急性肾小管损伤/坏死并不会影响ddcfDNA检测值对排斥的诊断,利用ddcfDNA值来识别非排斥损伤(包括ATI/ATN),可有助于减少不必要的活检次数。
研究筛选了穿刺活检30天内有配对ddcfDNA结果的样本,分为稳定组(141例患者,166个活检结果)和ATI/ATN组(64例患者,70个活检结果)。与ATI/ATN组相比,稳定组的KDPI中位值更低(IQR 49% vs 64%,p <0.05),冷缺血时间更短(13 vs 18小时,p<0.01)。ATI/ATN组更早进行活检(83.0天vs 116.5天,p<0.001),且eGFRs更低(32 vs 43mL/min,p<0.001)(图10)。稳定组和ATI/ATN组的ddcfDNA中位值无显著差异(0.23%,IQR:0.11-0.53 vs 0.21%,IQR:0.13-0.55,p = 0.993)(图11)。对首次活检期间的ddcfDNA值进一步分组(<0.5% vs ≥0.5%)发现,两组在术后1年并发症的发生率无显著差异(12.9% vs 27.5%,p=0.53),而≥0.5%组eGFR下降最为常见(78.5%发生率)。
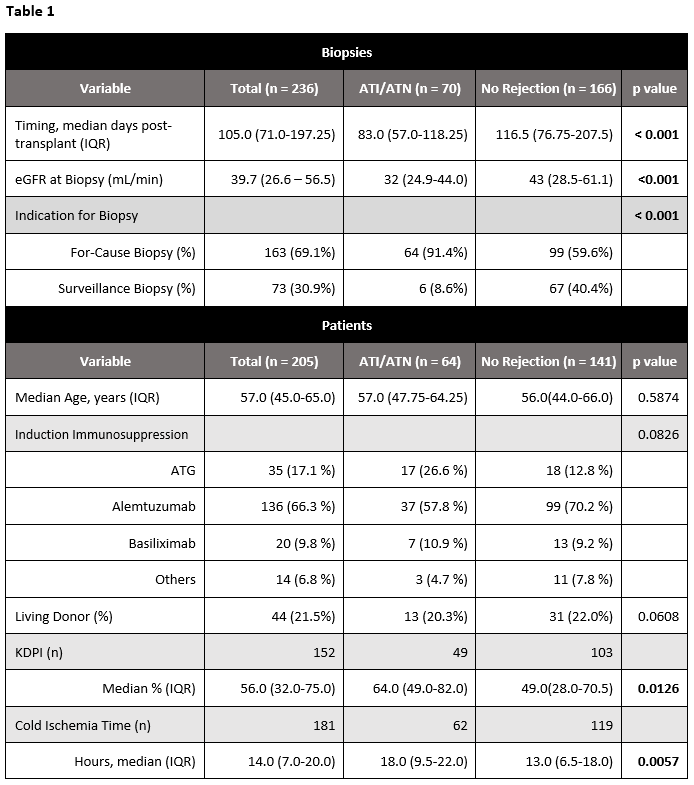 图10
图10
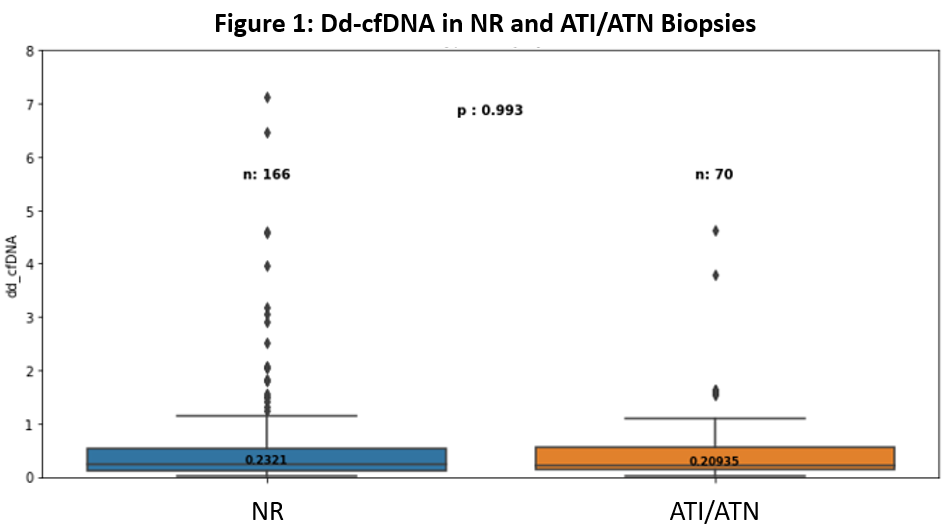 图11
图11
在肝移植术后缺血再灌注损伤的研究中,西奈山医疗中心(Mount Sinai Medical Center, New York)的结果发现,肝移植受者术后ddcfDNA值呈指数下降,这种下降趋势在活体供体肝移植受者中更快。肝移植手术14天后,在没有排斥反应、移植物功能障碍或感染的情况下,受者的ddcfDNA值可以恢复到稳定低水平。
这项研究入组了31例稳定期肝移植受者,在术后6个月内进行了114次检测,发现ddcfDNA值在术后第1周显著升高(中位数22.3%,IQR12.91-33.38%),在2周内迅速下降(图12A)。活体供体肝移植受者在术后第1周~第2周,ddcfDNA中位值显著下降(分别为33.8%、4.6%,p=0.01),术后14天以上的ddcfDNA中位值为2.5%(IQR 1.19-6.67%,图12B)。

图12
肺移植领域也发现类似ddcfDNA术后早期动力学变化。俄亥俄州立大学肺部危重症护理和睡眠医学系(Pulmonary, Critical Care & Sleep Medicine, The Ohio State University, Columbus)通过单中心前瞻性队列研究,首次证明了肺移植后ddcfDNA值的早期动力学特征,在排除移植物功能障碍、排斥反应或临床事件的情况下,肺移植后ddcfDNA值随着时间的推移而下降。
通过对20例肺移植受者(156个ddcfDNA检测结果)术后不同时间点的ddcfDNA值(图13)监测发现,ddcfDNA值随术后时间变化呈递减趋势(p = 3.1 e-9)(图14)。
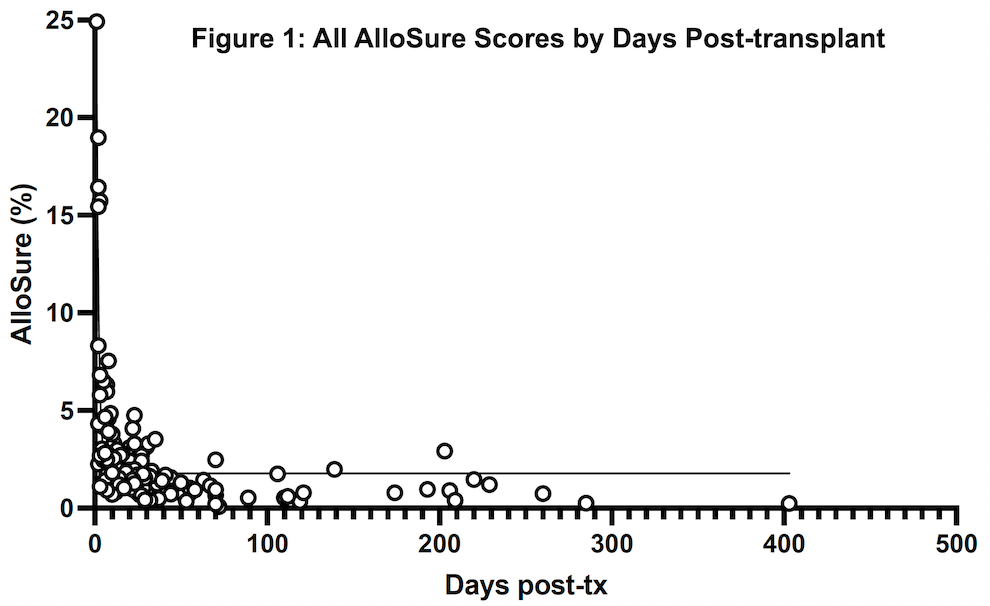 图13
图13
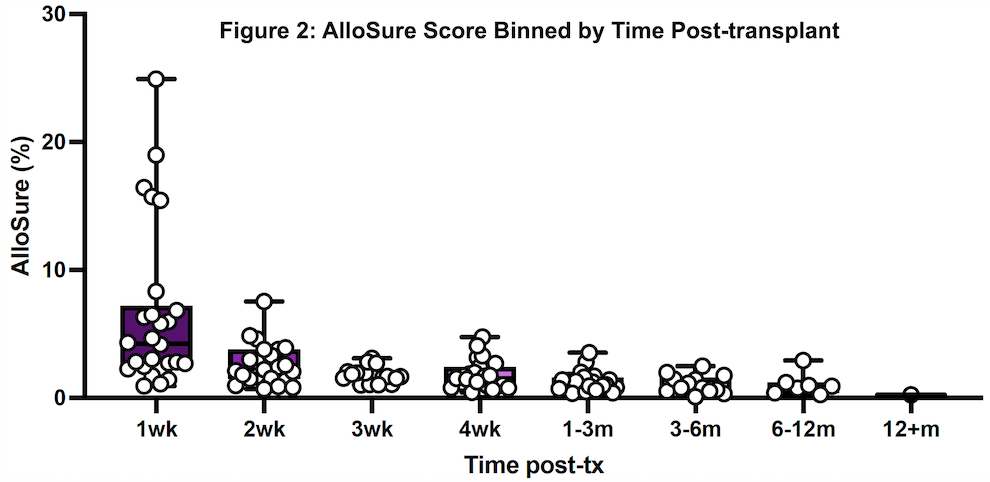 图14
图14
而德克萨斯大学圣安东尼奥分校健康科学中心(University of Texas Health System San Antonio, San Antonio, TX)的研究,进一步分析了ddcfDNA在肺移植后达到基线水平(<0.5%)所需时间。通过对8例肺移植患者术后6个月的动态ddcfDNA监测,发现移植术后70天以上,ddcfDNA中位水平才能稳定地下降到0.5%以下(图15)。
该研究认为,肺移植受者在术后60~90天内ddcfDNA值显著高于基线。结合患者FEV1变化推断可能是由于缺血再灌注损伤导致(图16),有必要进一步对不同受者的ddcfDNA 水平降至基线的初始差异进行检测分析。
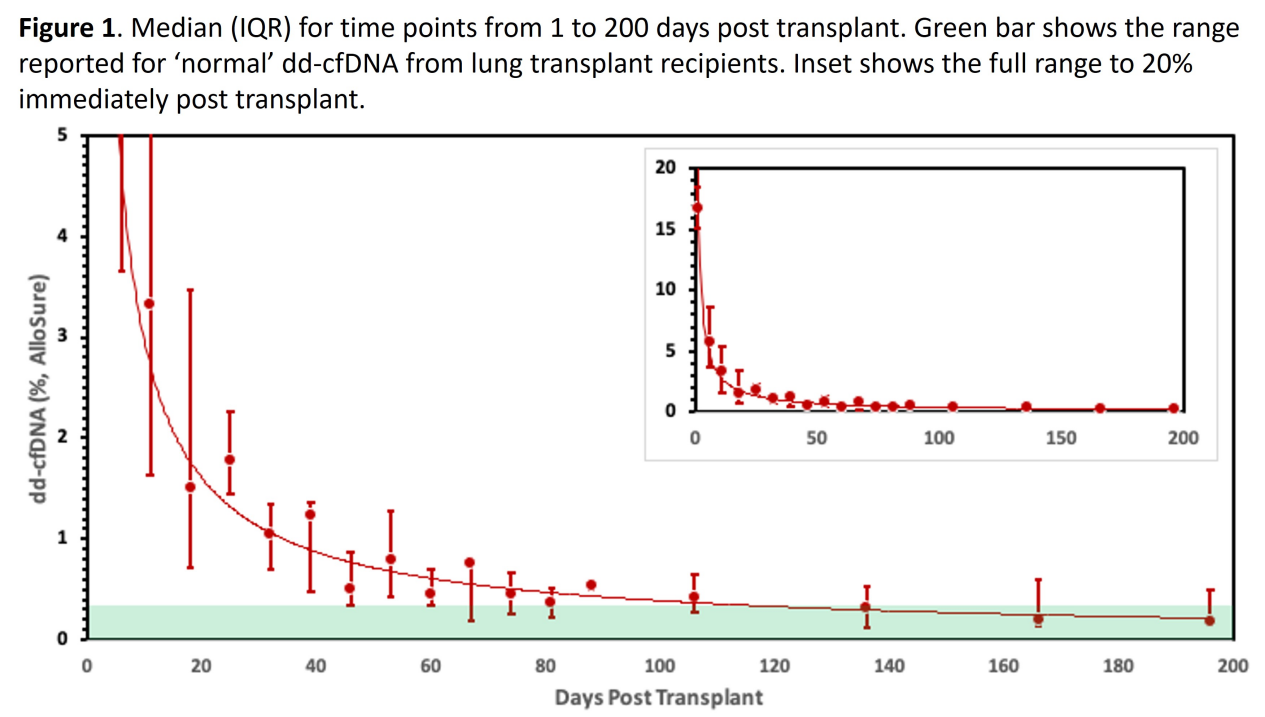 图15
图15
 图16
图16
疫苗是目前预防新冠肺炎的最有效措施,那么接种新冠疫苗是否影响ddcfDNA值?是否安全?
纽约大学朗格尼健康中心移植研究所(Transplant Institute, NYU Langone Health, New York)的研究认为,移植患者抗体反应与新冠感染史密切相关(图17),接种新冠疫苗不会影响ddcfDNA检测值,因为肾小球滤过率(eGFR)、ddcfDNA值、T细胞炎症基因表达谱(GEP谱)的稳定性及缺乏同种异体致敏性增强了肾移植受者接种疫苗的安全性。
该研究筛选符合疫苗接种条件的肾移植受者,在疫苗接种后12周内每周进行SARS-CoV-2抗体滴度、ddcfDNA值和GEP谱检测。分别在ddcfDNA基线处、完成疫苗接种2周和第12周时检测DSA,最终入组49 例患者进行分析(图17)。10例患者(20.4%)在接种疫苗后出现免疫应答峰值(a spike antibody response post- vaccination),其中80%(n=8)有新冠肺炎史,新冠肺炎史与疫苗反应的风险比为18.3(95% CI =3.2、105.0、p=0.0005)。ddcfDNA中位值在疫苗接种前后无显著差异(0.23% vs 0.21%)。GEP分数在接种前后也无显著差异(9.85 vs 10.4),没有患者在接种疫苗后出现临床上显著的DSA、eGFR下降或排斥反应(图18)。
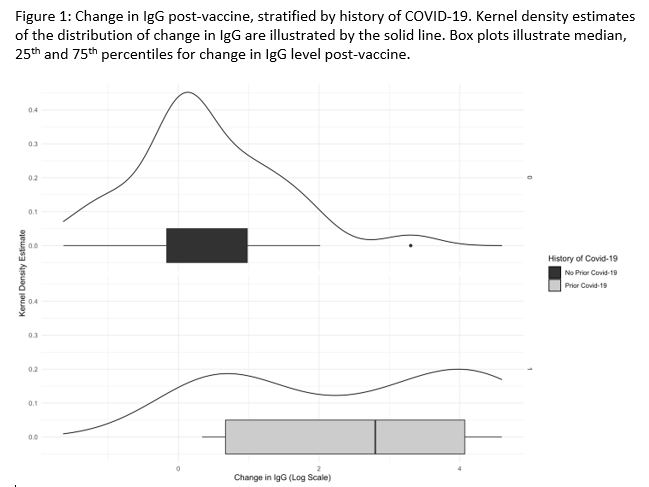 图17
图17
 图18
图18
在对接种新冠疫苗是否会诱导排斥反应的研究中,来自哥伦比亚大学欧文医学中心(Columbia University Irving Medical Center, New York)通过对移植受者在接种疫苗第1剂和第2剂时ddcfDNA相对值、绝对值以及总定量分析后认为:不会诱导排斥。
研究对53例受者在第1剂和第2剂疫苗接种时以及第2剂疫苗接种后1个月、3个月以及6个月进行血清肌酐、抗SARS-CoV-2 S抗体、DSA抗体和ddcfDNA值(相对值、绝对值、以及总定量,设定ddcfDNA≥1%和78 cp/mL表明排斥风险增加)检测,最终筛选了31例受者(女性为主(67%)和西班牙裔(48.3%),中位年龄55岁(range:19-81岁))纳入分析,除1例受者外,所有受者均接种辉瑞的mRNA疫苗。从移植到接种第1剂疫苗的平均时间为114.6个月(range:10-359个月),受者在接种第1剂和第2剂疫苗期间,没有发生排斥、住院或指征性活检。在接种第1剂到第2剂疫苗期间,没有发现ddcfDNA值或总cfDNA值的显著差异(图19)。1例受者的ddcfDNA%高于正常范围(0.14%,2.37%),但ddcfDNA绝对值在正常范围内(13.70 cp/mL,66.08 cp/mL)。在接种第1剂疫苗时,有2例患者的ddcfDNA%升高。在接种第2剂时,其中1例ddcfDNA%已恢复至正常范围(两次疫苗接种时ddcfDNA定量都正常),另1例的ddcfDNA%和定量值均保持升高趋势。
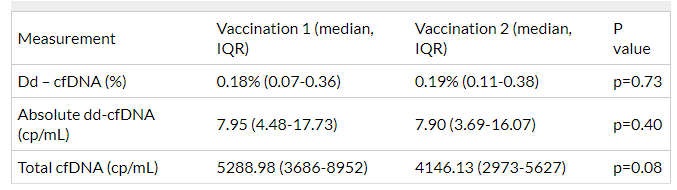 图19
图19
纽约大学朗格尼健康中心移植研究所(Transplant Institute, NYU Langone Health, New York)的研究,进一步分析了肾移植受者接种新型疫苗加强针对ddcfDNA的影响。
通过对116例接种新冠疫苗加强针的肾移植受者在疫苗接种前后(30天内)的ddcfDNA值进行监测(图20),接种加强针之前的ddcfDNA中位值为0.17%,取值中位时间为接种前9天(IQR 2.25-16)。发现在接种加强针后30天内,ddcfDNA中位值没有显著差异(图21),期间未发生不良临床事件或急性排斥反应。
这表明,ddcfDNA中位水平不受新冠疫苗加强针的影响,接种疫苗加强针不太可能出现加剧炎症、同种异体致敏或同种异体排斥的亚临床损伤。
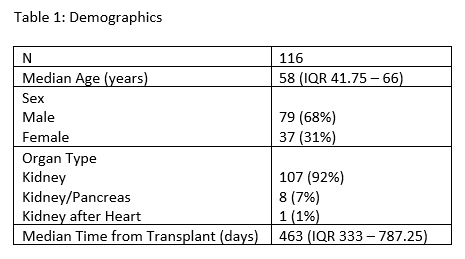
图20
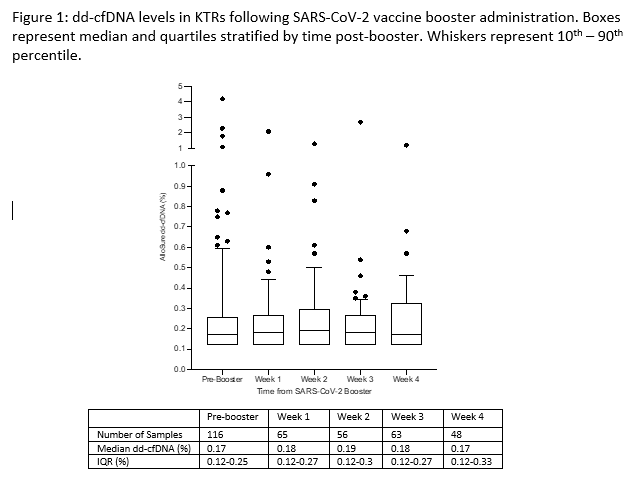
图21
总 结
一、供/受体的人口学特征、供体类型以及在术前诱导方案治疗均对ddcfDNA值无显著影响;
二、ATI/ATN并不会影响ddcfDNA检测值对排斥反应的诊断;
三、接种新冠疫苗不会引起排斥反应,接种后ddcfDNA检测值处于稳定状态。
*本文由上海奥根诊断技术有限公司医学部翻译编辑
资料来源
1.Gani I,et al.Donor/Recipient Variabilities and Dd-cfdna Level [abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/donor-recipient-variabilities-and-dd-cfdna-level/. Accessed August 4, 2022.
2.Alam A,et al.Impact of Donor and Recipient Characteristics on Early Post-Transplant Donor-Derived Cell-Free DNA (dd-cfDNA) Scores [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/impact-of-donor-and-recipient-characteristics-on-early-post-transplant-donor-derived-cell-free-dna-dd-cfdna-scores/. Accessed August 4, 2022.
3.DeFilippis EM, et al.The Use of Donor-Derived Cell-Free DNA in Female and Male Heart Transplant Recipients: A Sex-Specific Analysis of the Surveillance Heartcare Outcomes Registry [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/the-use-of-donor-derived-cell-free-dna-in-female-and-male-heart-transplant-recipients-a-sex-specific-analysis-of-the-surveillance-heartcare-outcomes-registry/. Accessed August 4, 2022.
4.Williams MD, et al.Racial Differences in the Predictability of Donor-Derived Cell-Free DNA Among Renal Transplant Recipients [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/racial-differences-in-the-predictability-of-donor-derived-cell-free-dna-among-renal-transplant-recipients/. Accessed August 4, 2022.
5.Sureshkumar KK, et al.Impact of Donor Type, Cold Ischemia Time, and Induction Type on Baseline Donor-Derived Cell-Free DNA in Kidney Transplant Recipients [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/impact-of-donor-type-cold-ischemia-time-and-induction-type-on-baseline-donor-derived-cell-free-dna-in-kidney-transplant-recipients/. Accessed August 4, 2022.
6.Dandamudi R, et al.Plasma Donor-Derived Cell-Free DNA Longitudinal Kinetics After Kidney Transplantation in Children [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/plasma-donor-derived-cell-free-dna-longitudinal-kinetics-after-kidney-transplantation-in-children/. Accessed August 3, 2022.
7.Allam SR,et al.Acute Tubular Injury and Necrosis Do Not Lead to Meaningful Elevations in Donor-Derived Cell-Free DNA (dd-cfDNA) [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/acute-tubular-injury-and-necrosis-do-not-lead-to-meaningful-elevations-in-donor-derived-cell-free-dna-dd-cfdna/. Accessed August 3, 2022.
8.Florman S,et al.Baseline Levels and Early Post-Transplant Kinetics of Donor-Derived Cell-Free DNA Following Liver Transplantation [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/baseline-levels-and-early-post-transplant-kinetics-of-donor-derived-cell-free-dna-following-liver-transplantation/. Accessed August 4, 2022.
9.Botros MM,et al.Surveillance with Allosure for Allograft Rejection and Infection in Lung Transplant [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/surveillance-with-allosure-for-allograft-rejection-and-infection-in-lung-transplant/. Accessed August 3, 2022.
10.Levine D,et al.The Unique Course of dd-cfDNA After Lung Transplant [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/the-unique-course-of-dd-cfdna-after-lung-transplant/. Accessed August 4, 2022.
11.Ali NM,et al.Antibody Response and Molecular Graft Surveillance in Kidney Transplant Recipients Following Sars-CoV-2 Vaccination [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/antibody-response-and-molecular-graft-surveillance-in-kidney-transplant-recipients-following-sars-cov-2-vaccination/. Accessed August 3, 2022.
12.Verduzco HAlvarado,et al.Impact of Sars-CoV-2 Vaccination on Donor-Derived Cell Free DNA Levels in Renal Transplant Recipients [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/impact-of-sars-cov-2-vaccination-on-donor-derived-cell-free-dna-levels-in-renal-transplant-recipients/. Accessed August 3, 2022.
13.Ali NM,et al.Kinetics of dd-cfDNA in Kidney Transplant Recipients Following Sars-CoV-2 Vaccination Booster Administration [abstract]. Am J Transplant. 2022; 22 (suppl 3). https://atcmeetingabstracts.com/abstract/kinetics-of-dd-cfdna-in-kidney-transplant-recipients-following-sars-cov-2-vaccination-booster-administration/. Accessed August 4, 2022.






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国