这是 达医晓护 的第 3999 篇文章
非小细胞肺癌(non-small cell lung cancer,NSCLC)手术切除后残留肿瘤评价通常根据切缘是否残留肿瘤行国际癌症控制联盟(Union for International Cancer Control,UICC) R分类。为了评价手术质量对预后的影响,国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)于2005年提出了NSCLC包含术中淋巴结评价情况的新R分类[1]。IASLC-R分类引入了一个新的类别,不确定切除R(un)。在一项国际多中心IASLC回顾性队列研究和美国的一项多中心研究中[2,3],57%到64%的患者从UICC-R0切除重新归类到IASLC- R (un)切除。在重新分类的患者中,96% - 98%是由于未能行按照系统性淋巴结清扫(systematic nodal dissection,SND)或肺叶特异性淋巴结清扫(lobe-specific nodal dissection,LSND)标准定义的充分淋巴结评估。为了满足IASLC-R0切除的严格标准,对所有可切除的NSCLC进行标准的淋巴结评估可能会导致术中不必要的额外有创操作。在具有影像学低风险特征的早期肿瘤如磨玻璃成分(ground-glass opacity,GGO)为主的病变以及淋巴结转移的风险较低时,IASLC-R0标准的淋巴结清扫是否对患者来说是否是获益的尚不能确定[4,5]。因此,该研究根据淋巴结清扫的范围对IASLC-R分类进行了再分类,并利用大样本的接受以根治为目的手术的NSCLC患者评估不同的分期和组织学亚型中该分类与复发和长期生存的关系。
该研究纳入了在2008年至2016年期间接受根治性NSCLC手术的I - III期共5595例临床患者**(图1)**,分别有2806例、2445例和344例患者分别属于IASLC-R0、R(un)和R1/2。根据SND的标准将R0和R(un)依据是否获得足够的N1、N2以及7组淋巴结清扫分为8组,进一步将这8组分类为3类:完全满足(fully compliant group,FCG)2806例,部分满足(partially compliant group,PCG)1950例,不满足(noncompliant group,NCG)352例。由于收集的影像学数据中缺乏肿瘤实行成分描述,该研究使用贴壁生长成分代替了影像学中GGO成分评价。
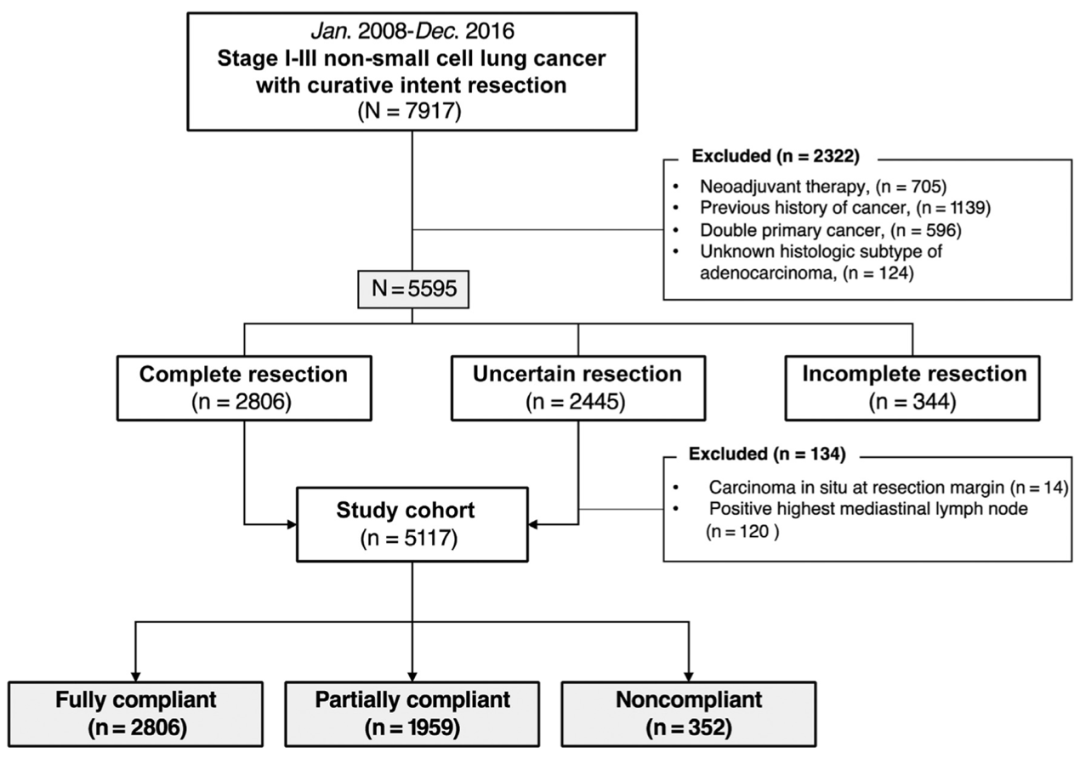
图1. 患者入组流程图结果显示,5595例患者的中位年龄为62岁(IQR:52-69岁),其中61.6%为男性。采用IASLC标准,50.2%(2806)、43.7%(2445)和6.1%(344)的患者分别被归为R0、R(un)和R1/2。UICC-R0(98.7%,n = 5520)分类至IASLC-R(un)和IASLC-R1/R2的最常见原因分别是淋巴结评估不充分(97.4%)和淋巴结外侵犯(97.9%)。与R0患者相比,R(un)患者的肿瘤较小,临床I期和贴壁生长腺癌占比例较高,并且接受亚肺叶切除的比例较高。
中位随访时间58.0个月(IQR: 39-79个月),R0、R(un)和R1/R2的5年OS分别为80.1%、84.7%和49.8%(p < 0.001)。与R0比较,R(un)和R1/ R2的死亡aHR分别为0.78(95% CI: 0.69 ~ 0.88)和1.10(95% CI: 0.96 ~ 1.26)。
在排除了切缘原位癌(adenocarcinoma in situ,AIS)(14)、最高站淋巴结阳性(120)的病人后5117例患者进行了IASLC-R再分类,54.8%(2806)、38.3%(1959)和7.0%(352)的患者分别被归为FCG、PCG和NCG组。NCG和PCG两组的基线特征相似。与FCG相比,NCG和PCG组女性与不吸烟患者占比较高,Charlson合并症指数较低,临床分期为IA2(52.3%)、IA1(20.2%)和病理I期(91.5%)以及接受亚肺叶切除术(78.5%)的比例更高。NCG、PCG和FCG三组的临床肿瘤大小逐渐增大(中位数:16、24和28 mm)。此外,伴有贴壁生长成分的腺癌在NCG中最常见(NCG、PCG和FCG中分别为51.4%、22.6%和13.3%)。
中位随访57.0个月(IQR: 37-144个月),1301例患者复发,906例患者死亡。FCG、PCG和NCG的5年RFS分别为69.7%、74.5%和86%(p < 0.001), 5年OS分别为80.1%、84.5%和89.9%(p < 0.001)(图2)。校正年龄、性别和切除范围后,PCG和NCG与FCG复发的aHR分别为0.85(95% CI: 0.81-0.95)和0.62(95% CI: 0.45-0.85)。进一步矫正组织学亚型和临床分期后,结果不再显著(PCG的aHR = 0.94 [95% CI: 0.84-1.06],NCG的aHR = 0.85 [95% CI: 0.62-1.17])。矫正后三组的OS不再有统计学差异。
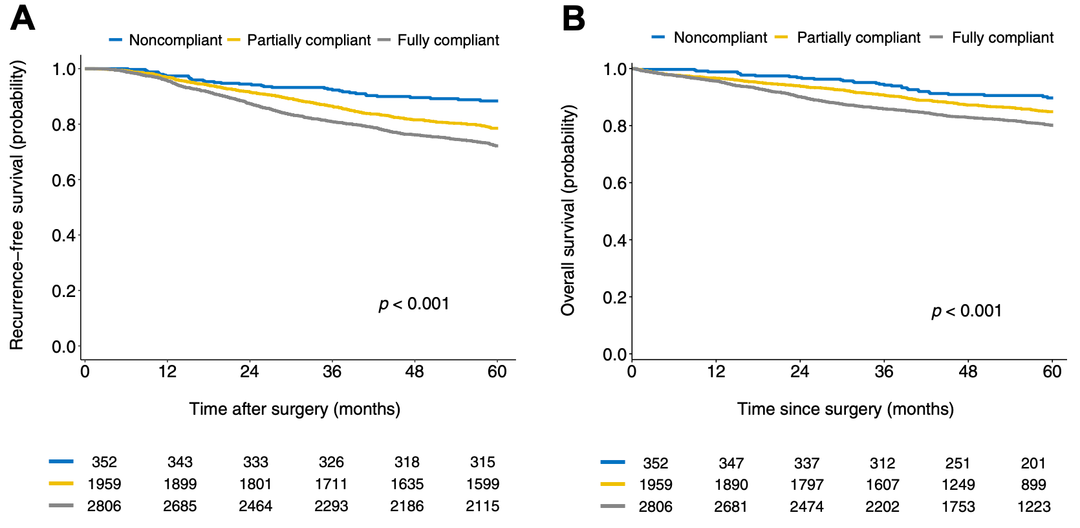
图2. IASLC残余肿瘤再分类各组生存结果:(a)无复发生存率;(b)总生存率。
在临床I期患者中,NCG的5年RFS(p < 0.001)和OS(p < 0.001)最好,其次是PCG和FCG(5年RFS分别为87.5%,79.5%和75.2%;5年OS分别为88.6%、87.2%和75.2%)。在临床II期患者中,NCG的5年RFS和OS低于PCG和FCG**(图3)**。
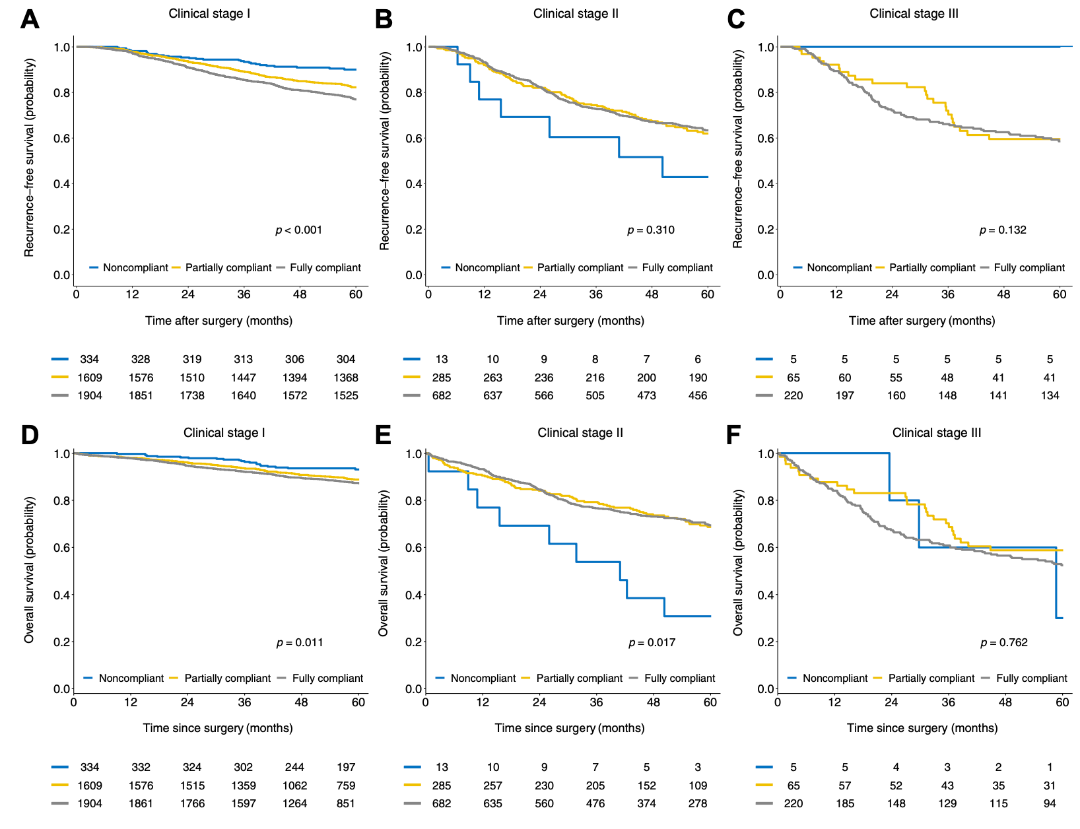
图3. 临床分期各亚组中的无复发生存率和总生存率:I期(A,D),II期(B,E)和III期(C,F)。
在有贴壁生长成分的腺癌中,NCG的5年RFS(p < 0.001)和OS(p = 0.007)最好,其次是PCG和FCG(5年RFS分别为96.9%,88.3%和86.3%;5年OS分别为97.6%、95.3%和92.4%)。在不含贴壁生长成分的腺癌中,NCG的5年RFS高于PCG和FCG;然而,三组间的OS没有差异。在非腺癌中,三组间的RFS或OS没有差异**(图4)**。

图4. 根据组织学类型分类各亚组无复发生存率和总生存率:含贴壁生长成分腺癌(A,D),不含贴壁生长成分腺癌(B,E)以及非腺癌(C,F)。
3428例(67.0%)I期患者中,AIS10例,微浸润腺癌(minimally invasive adenocarcinoma ,MIA)98例。IA1期523例,IA2期1108例,IA3期898例。AIS数量较少,因此该研究结合AIS和MIA(AIS/MIA)进行分析。三组AIS/MIA、IA1、IA2的RFS和OS无差异。在IA3中,虽然三组间RFS没有差异,但三组间的OS存在统计学差异(p = 0.021),其中FCG的OS优于PCG (FCG vs PCG, p = 0.049)。
这些结果说明对于具有低风险组织学亚型的早期NSCLC,放宽淋巴结评估标准并不会导致较差的预后。虽然外科医生应该继续以完全切除和标准的淋巴结评估为目标,但是否需要对所有类型的NSCLC进行完全一致的淋巴结评估可能需要重新考虑。
述评
这项研究纳入了超过5000例NSCLC患者,IASLC-R(un)的RFS和OS优于IASLC-R0。根据是否符合SND标准将R0和R(un)重新划分为FCG、PCG和NCG三组后,NCG的RFS和OS优于PCG和FCG。但在根据临床分期和组织学亚型矫正后,差异不再显著,提示三组间的RFS和OS差异主要是由于肿瘤特征差异所致。临床I期和含有贴壁生长成分腺癌亚组中NCG的预后较好。
在这项研究中,98.7%的患者符合UICC-R0标准;然而,只有一半的患者符合IASLC-R0标准。IASLC的R分类强调了各站淋巴结中行充分淋巴结评估的重要性。因此,IASLC-R0采用比UICC-R0更严格的标准,需要SND或LSND进行足够的淋巴结评价。在这项研究中,尽管淋巴结切除的数量较多,IASLC-R0中有20个(15-26个)淋巴结被切除,甚至在IASLC-R(un)中,有11个(6-16个)淋巴结从5个(3-6个)淋巴结站点切除,但97%被归入IASLC-R(un)仍然是因为淋巴结评估不够充分。值得注意的是,这项研究中IASLC-R(un)的5年RFS和OS优于IASLC-R0,这与以往大多数R(un)比R0预后更差的研究结果相反[3]。这似乎是由于这项研究中R(un)患者的肿瘤临床病理特征导致的,与R0患者相比,IASLC- R(un)患者肿瘤较小、临床I期和带有贴壁生长成分腺癌的比例较高。
不充分的淋巴结评估是IASLC-R(un)的最常见原因(97%)。考虑到充分淋巴结评估的重要性,这项研究根据SND标准的符合程度对IASLC- R0和R(un)进行了重新分类。基于该标准,85%的R(un)患者归为PCG,即使有多达16个淋巴结被切除,其余R(un)患者归为NCG。与PCG或FCG相比,NCG组的肿瘤更小,临床分期更早,且有贴壁生长成分,这表明在淋巴结转移风险较低的患者中,外科医生行标准淋巴结评估的意愿较低。相比之下,淋巴结转移风险高的患者切除的淋巴结范围更广,数量更多,因此较多被归于FCG组。该研究中NCG比PCG或FCG有更好的RFS和OS。这与一项关于I期亚实性肺腺癌的回顾性队列研究的结果相似,在GGO为主的肿瘤中,SND并没有比单纯行肺门淋巴结清扫有更好的OS[5]。相比之下,不含GGO成分的实体肿瘤则被认为表现出高度恶性行为,即使在临床I期,也可发现约15% - 20%的隐匿性淋巴结转移[6,7]。在这种情况下,需要根据影像学特征调整淋巴结评估的范围。因此,同样程度的淋巴结评估不适用于所有可切除的肺癌。相反,淋巴结评估的范围和充分性应该基于肿瘤生物学特点及其风险采用一种更有针对性的标准。
该研究表明NSCLC治疗中一种基于风险及肿瘤生物学特征的分类淋巴结评估策略可能是必要的。然而这仍然需要设计良好的前瞻性随机对照试验对该观点进行进一步验证。
参考文献:
[1].Rami-Porta R, Wittekind C, Goldstraw P. Complete resection in lung cancer surgery: proposed definition. Lung Cancer 2005;49:25-33.
[2].Edwards JG, Chansky K, Van Schil P et al. The IASLC Lung Cancer Staging Project: Analysis of Resection Margin Status and Proposals for Residual Tumor Descriptors for Non-Small Cell Lung Cancer. J Thorac Oncol 2020;15:344-359.
[3].Osarogiagbon RU, Faris NR, Stevens W et al. Beyond Margin Status: Population-Based Validation of the Proposed International Association for the Study of Lung Cancer Residual Tumor Classification Recategorization. J Thorac Oncol 2020;15:371-382.
[4].Sano Y, Shigematsu H, Okazaki M et al. Hoarseness after radical surgery with systematic lymph node dissection for primary lung cancer. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery 2019;55:280-285.
[5].Hattori A, Matsunaga T, Takamochi K, Oh S, Suzuki K. Significance of Lymphadenectomy in Part-Solid Lung Adenocarcinoma: Propensity Score Matched Analysis. The Annals of thoracic surgery 2018;106:989-997.
[6].Ye T, Deng L, Wang S et al. Lung Adenocarcinomas Manifesting as Radiological Part-Solid Nodules Define a Special Clinical Subtype. J Thorac Oncol 2019;14:617-627.
[7].Ye B, Cheng M, Li W et al. Predictive factors for lymph node metastasis in clinical stage IA lung adenocarcinoma. The Annals of thoracic surgery 2014;98:217-23.
<上下滑动查看参考文献>

**本文作者:**同济大学附属上海市肺科医院胸外科 住院医师 安朝
策划设计:王海峰 谢冬 赵晓刚
主审监制:姜格宁 朱余明
本文内容转载自“肺科胸外通”微信公众号







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国