“基因编辑”近年来在生物学领域如雷贯耳,而以 CRISPR/Cas 为代表的基因编辑系统,正是其中的“当红明星”。就在2020年,CRISPR/Cas领域的开创者埃马纽埃尔·卡彭蒂耶和詹妮弗·杜德纳,摘得了诺贝尔化学奖桂冠。由于CRISPR/Cas在治疗、检测、育种等应用中表现出了非凡潜力,相关的研究如同雨后春笋般不断涌现。
 不过,这个系统长期以来也有一些难以攻破的“缺陷”,最突出的一个问题就是传统的Cas蛋白分子尺寸普遍太大,导致包装困难,这就限制了它们在基因治疗方面的使用。所以, 开发更小的编辑工具 ,成为当前这个领域的重要研究方向之一 ,也是各国竞争激烈的一块“高地”。
不过,这个系统长期以来也有一些难以攻破的“缺陷”,最突出的一个问题就是传统的Cas蛋白分子尺寸普遍太大,导致包装困难,这就限制了它们在基因治疗方面的使用。所以, 开发更小的编辑工具 ,成为当前这个领域的重要研究方向之一 ,也是各国竞争激烈的一块“高地”。
9月2日,上海科技大学物质科学与技术学院的季泉江课题组,在《自然-化学生物学》( Nature Chemical Biology )上报道了一种全新的基因编辑工具CRISPR-AsCas12f1。 这是迄今发现最小的有编辑活性的Cas蛋白,仅422个氨基酸,比传统的Cas9小一半以上 。那么这一基因编辑工具有什么特点?与其他已有工具相比有哪些优势?应用前景又如何?对此,我们请课题组负责人季泉江教授来聊聊他的看法。
 季泉江课题组发表在《自然-化学生物学》的极小CRISPR基因编辑系统论文截图 | Nature
季泉江课题组发表在《自然-化学生物学》的极小CRISPR基因编辑系统论文截图 | Nature
CRISPR系统是如何成为今天的主流基因编辑工具的?
季泉江 :在CRISPR系统发现之前,主要用的是ZFN和TALEN核酸酶系统,它们也能实现一部分基因编辑的功能,但是具体操作起来十分困难,而且效率效果上都非常不理想。2012年CRISPR技术出现之后,ZFN和TALEN很快就被淘汰了。 CRISPR系统大致相当于是细菌的“免疫系统” ,它是用来对付噬菌体的,包括一串能记录噬菌体信息的DNA序列、一段能当向导的RNA,以及一把能切割噬菌体DNA的“剪刀”——Cas蛋白。噬菌体会感染和杀死细菌,但偶尔有细菌逃过一劫,就有机会通过CRISPR系统把噬菌体的DNA碎片收集起来,做成“档案”放进自己的基因组里。之后如果再有相同的噬菌体来入侵,细菌就可以派Cas蛋白按图索骥去剪断噬菌体的DNA,防止再次“感染”。
获得诺奖的两位科学家,就是揭示了Cas9蛋白具体是如何在RNA引导下去切割DNA的,知道了它的机制,我们就可以自己制造“新档案”, 让CRISPR系统去切我们设计的目标DNA,实现基因编辑的功能 。后来随着CRISPR技术的不断拓展,又衍生出其他很多应用,不仅能切目的基因,还能在细胞里标记特定基因的位置,特异性激活某些基因的转录,还能在不切断DNA的情况下修改基因等等。这样CRISPR就成为目前全世界最流行的基因编辑工具。
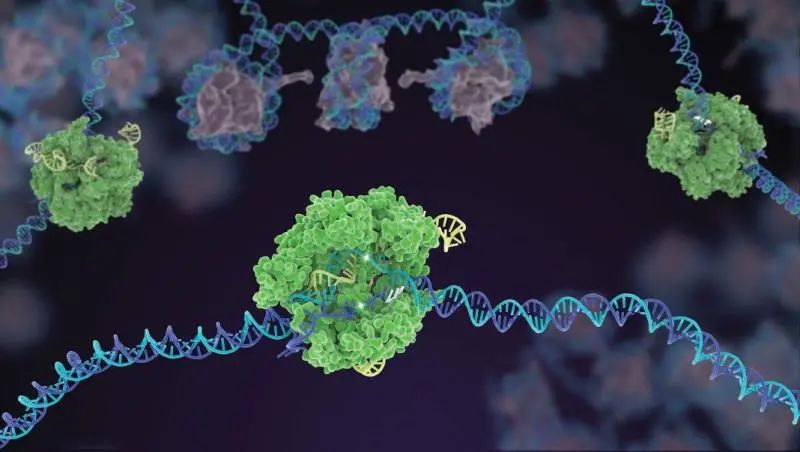 CRISPR/Cas系统开启了基因编辑的新纪元 | Janet Iwasa for the Innovative Genomics Institute at UC Berkeley
CRISPR/Cas系统开启了基因编辑的新纪元 | Janet Iwasa for the Innovative Genomics Institute at UC Berkeley
近年来不断有更小的Cas蛋白陆续报道出来,这类“极小型”的基因编辑工具有什么特殊的意义?
季泉江 :有了CRISPR基因编辑技术,就有机会用它去 治疗一些以前没有办法治愈的遗传疾病 。但是要治疗基因缺陷疾病,不是像平时吃药那么简单把药吃到胃里,而是得想办法把基因编辑工具送到细胞里面,这就 需要一个能通往细胞内部的“运输车”来完成这个任务 。而目前公认最安全有效的“运输车”是一种腺相关病毒AAV,这种病毒经过人工改造,不带有任何会致病的基因,也不能自我复制,并且可以让它只进入一些特定的器官或组织,所以AAV就成为了非常可靠的运输工具。
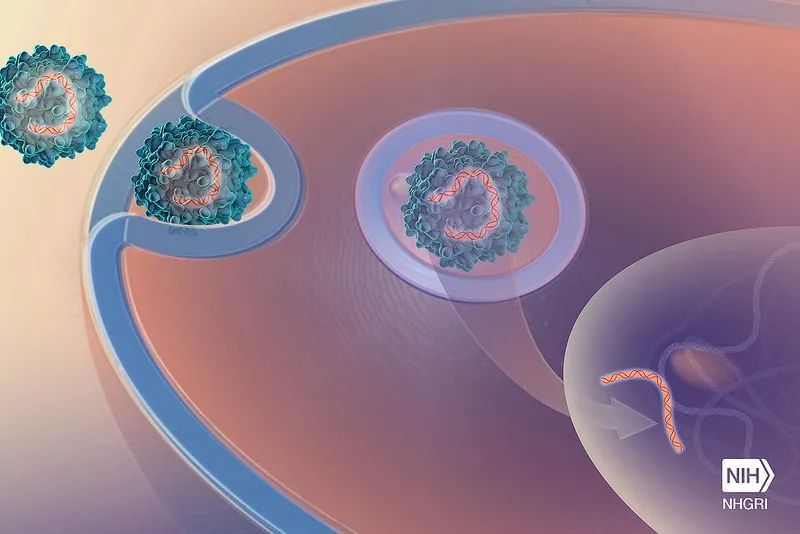 利用病毒实现向细胞内部“送货”的功能 | NIH
利用病毒实现向细胞内部“送货”的功能 | NIH
但美中不足的是,AAV的容量很有限,最多只能容纳约4700个碱基对的DNA序列。目前主流的基因编辑工具,类似Cas9和Cas12a,它们的编辑效率虽然很高,但是这些基因编辑系统分子尺寸都比较大,仅核酸酶的部分就普遍大于1,000个氨基酸 (3000个碱基对) ,如果再加上引导RNA、启动子等其它元件,就已经超过了单个AAV的装载极限。这就好比我们要搬家,卡车容量是固定的,如果家具体积都很大,一辆车装不下,就只能多花钱再雇一辆。现在很多基因编辑器的递送也采用了这种方法,将编辑器拆成两份分别装在两个AAV中,让它们到达细胞之后再组装起来发挥功能。但如果我们的家具都很小,一辆车就能装完,不仅装下Cas蛋白,还能同时带上一些其他的功能元件,就能节约很多成本,同时提高了效率。这也就是开发小型编辑工具的意义。最近几年,关于小型CRISPR系统的研究报道也逐渐增加,大多都是Doudna团队做的工作。
 近年来小型CRISPR系统的研究大多由詹妮弗·杜德纳团队完成 | American Academy of Achievement
近年来小型CRISPR系统的研究大多由詹妮弗·杜德纳团队完成 | American Academy of Achievement
您是如何关注到Cas12f系统的?
季泉江 :小型CRISPR系统一直是我们研究团队关注的重点,之前我们就报道了一种嗜热链球菌的小型Cas9蛋白(St1Cas9),阐明了它识别和切割靶向DNA链的具体分子机制,论文去年发表在《自然·催化》( Nature Catalysis )杂志上。
2020年初的新冠疫情期间,我们注意到一个比较特殊的蛋白,就是Cas12f。这个酶最早是Doudna课题组在2018年报道的,当时只发现它能靶向切割单链DNA,而在体内的测试中没有表现出切割双链DNA的活性。不能在体内切割双链DNA,意味着无法实现更多的编辑功能,所以当时推测这个酶不能成为基因编辑工具。
在这之后,立陶宛的一个课题组又重新鉴定了Doudna发现的蛋白,同时还鉴定了一批它的同源蛋白。他们发现, 这类蛋白在体外的生化反应中,其实是可以依赖PAM (注:PAM是Cas蛋白识别切割位点的特殊DNA序列) 去切割双链DNA的 ,这就极大激发了我们的研究兴趣。所以,我们当时就想进一步探索一下它到底是否具有基因编辑活性。由于我们课题组之前在细菌基因编辑方面的积累了不少经验,就迅速做了一些测试,结果意外地发现,这个蛋白家族中的AsCas12f1在细菌里的基因编辑效率很高,和Cas9差不多,于是我们开始着手系统地研究这个蛋白。
 季泉江教授 | 张雅拍摄
季泉江教授 | 张雅拍摄
AsCas12f1有哪些核心特征?
季泉江 :AsCas12f1来自于一种 嗜热细菌 ( Acidibacillus sulfuroxidans )。这种细菌最早是在美国黄石国家公园的热泉里发现的。
AsCas12f1有几个非常独特的地方。首先它 识 别核酸的方式很特殊 ,之前的Cas9、Cas12a等都是依靠 单个Cas蛋白 来识别DNA和引导RNA的。而AsCas12f1则是通过 两个相同的蛋白形成不对称的二聚体 来识别DNA和引导RNA的,这2个蛋白的氨基酸序列是完全相同的,但它们各自空间结构却不同,通过“二合一”拼成一个新的蛋白复合体。这样的分子机制是非常罕见和新颖的,我们在看到它的同源蛋白结构之后,都不由感叹大自然的鬼斧神工,从某种意义上来说,这也 解释了为什么编码这个蛋白所需碱基数比Cas9少一半以上 。
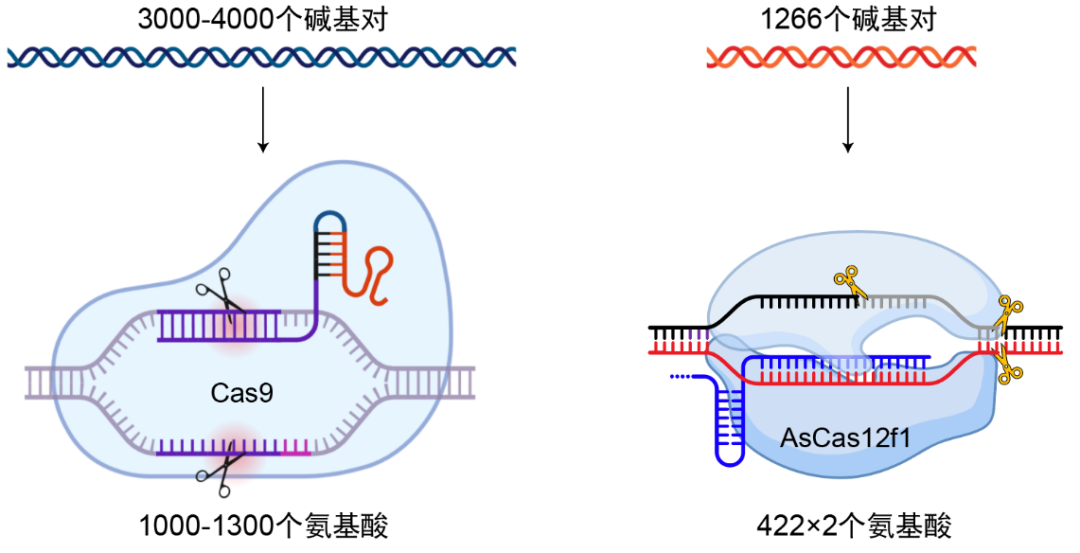 Cas9是一个完整的“大”蛋白,而Cas12f是两个同源“小”蛋白组合成的蛋白复合体,后者所需碱基数不到前者的一半 | 莜柒绘制
Cas9是一个完整的“大”蛋白,而Cas12f是两个同源“小”蛋白组合成的蛋白复合体,后者所需碱基数不到前者的一半 | 莜柒绘制
其次, AsCas12f1切割DNA的机制也与以往的Cas蛋白差异很大 。以往发现的Cas蛋白通常是在DNA靶向序列的内部(是指Cas蛋白要识别的那段DNA序列)进行切割2次,切断DNA的2条链,留下的切口通常是整齐的平末端或者仅有几个碱基的黏性末端。而AsCas12f1的 核心切割位点在靶序列之外 ,分别在靶向链(指与引导RNA结合的那条DNA链)上切1次,在非靶向链上切2次, 一共切3次 。这样就形成了一组不对称的切口,在靶向链上留下一段较长的DNA“尾巴”。这种不对称的双链切割模式目前是比较罕见的,其它Cas蛋白也有在靶序列外剪切的,但切口通常都是对称的。我们认为这种不对称切割的特征,可用来连接一些经过设计的特殊序列。
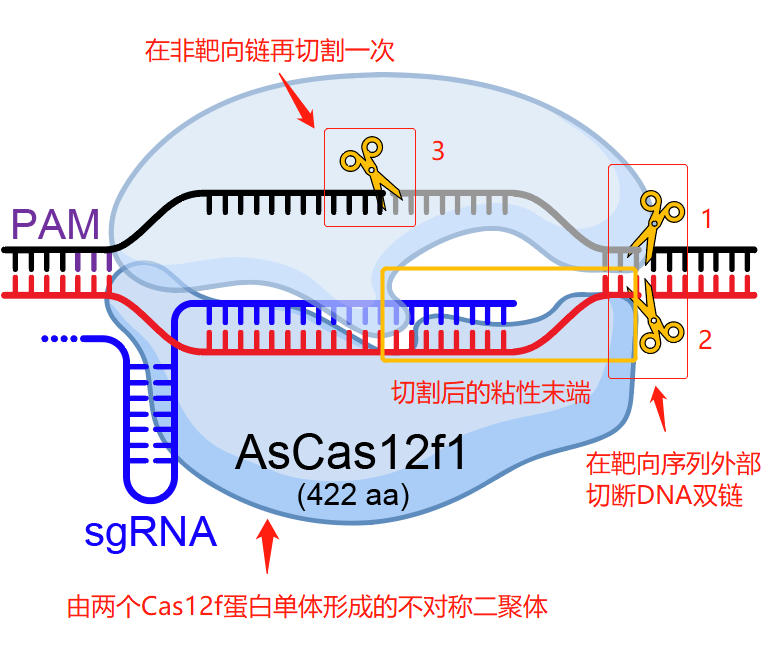 AsCas12f1切割DNA的机制 | 莜柒绘制
AsCas12f1切割DNA的机制 | 莜柒绘制
另外,由于这种的蛋白来自于嗜热细菌,所以它 非常耐热 ,最适反应温度在45℃到60℃。蛋白性状稳定,不容易降解,这对工业化生产和一些体外应用都非常有利。
AsCas12f1系统目前的编辑效果如何?如何解决脱靶等问题?
季泉江 :我们刚开始是在细菌上进行测试的,主要测试了大肠杆菌和肺炎克雷伯氏菌。它在细菌上的编辑效率与Cas9是不相上下的,最高可以达到100%。我们也在哺乳动物细胞上做了初步的测试,测试的位点里面最高大概在30%左右,目前效率还赶不上Cas9、Cas12a这些常用的Cas蛋白。我们也做过这个蛋白脱靶相关的测试,发现确实有脱靶现象的存在。针对效率和脱靶的问题,我们准备通过 分子进化 的方法进行改进,这也是目前比较常用的一种方法。
 利用分子进化可以对CRISPR系统加以改进 | Pixabay
利用分子进化可以对CRISPR系统加以改进 | Pixabay
做分子进化可以 基于蛋白质的结构来进行理性设计,或者利用随机突变找到功能更好的蛋白 ,这两种方法我们课题组也都在用。比如我们的蛋白结合核酸的能力相比Cas9较弱,那就可以把跟核酸结合区域的氨基酸突变成带正电的氨基酸,这样就能与带负电的核酸有更强的结合力;再比如可以通过引入一些额外的相互作用,改变它对PAM的识别,拓展识别范围。而脱靶主要是由于Cas蛋白有时会切割一些与引导RNA匹配不完美的其他序列,我们就可以通过理性设计优化Cas蛋白和核酸的互作,减少蛋白对不完美匹配的容忍度,来降低脱靶的几率。
这项成果有哪些应用前景?
季泉江 :不论是AsCas12f1蛋白自身,还是用它改造出的一些衍生基因编辑工具,我觉得都可以应用在 疾病治疗 方面,比如说遗传性疾病、感染性疾病的治疗。另一个就是可以利用Cas12家族蛋白的附加切割活性,将它改造成 核酸检测的工具 ,这种检测工具的精度能够分辨出1个碱基的差异,通常半小时就可以看到检测结果,后期可能提高到更快,在 对新冠病毒这样的病原体进行快速检测和分型上很有前景 。
 AsCas12f1系统对病原体的快速检测和分型很有前景 | Pixabay
AsCas12f1系统对病原体的快速检测和分型很有前景 | Pixabay
在进行这项研究的过程中遇到了哪些困难?
季泉江 :总体来说我们在实验的部分还是进展比较顺利的,但是投稿过程中确实遇到了比较郁闷的阶段。我们最先投稿到《科学》,《科学》的编辑还是比较欣赏这个工作的,但最终还是被杂志的顾问委员会拒掉了。之后我们转投到了《自然·生物技术》,《自然·生物技术》的编辑也很认可,并很快送审了我们的文章。一审我们得到了三份相对来说中立且积极的审稿意见,经过了几个月补充实验后再次送审。二审时有两位审稿人已经同意文章发表,但有一位审稿人却变得比较消极和反对,最终编辑还是拒掉了我们的稿件。接下来我们将文章转至《自然》系列的另一个杂志《自然·化学生物学》,《自然·化学生物学》的编辑根据之前的审稿意见,没有再次送审,直接接收了我们的文章。
您认为要获得此类创新度比较高的科研成果,有哪些因素至关重要?
季泉江 :我觉得实验室前期的 基础积累 是非常关键的,因为要做原创的基因编辑系统开发,就要求有很全面的综合能力,其中包括对微生物学、分子生物学、细胞生物学、结构生物学、生物信息学等领域的知识储备和技术积累;对于这些系统无论在分子层面也还是细胞层面,都要有非常深入的理解,这样整体工作推动起来会比较顺利,如果存在任何某一方面的短板,都可能遇到难以突破的阻碍;另一方面也需要一个良好的实验室氛围,我们团队成员相处比较融洽,并且已经建立起了知识和实验技术的传承体系,让学生在研习期间能尽快学到必要的核心技术。
 季泉江老师指导学生挑选蛋白质晶体 | 季泉江课题组提供
季泉江老师指导学生挑选蛋白质晶体 | 季泉江课题组提供
基因编辑相关热点研究竞争激烈,您未来有哪些研究计划,可能面临的挑战是什么?
季泉江 :竞争确实是一直有的,比如最早立陶宛的研究团队与Doudna团队几乎同时投稿了关于Cas9的关键研究,但因为立陶宛团队的投稿过程非常不顺利,几经辗转,论文发表时已落后于Doudna,最终无缘诺奖。再比如今年年初,东京大学的团队在《分子·细胞》上首先报道了与我们的AsCas12f1同源的Un1Cas12f1的结构,而就在第二天,普渡大学的另一团队将自己做的相似的工作上传到了BioRxiv (预印本平台,供作者先行上传未经同行评议的论文) 。前一段时间两个团队几乎同时在BioRxiv上传了Cas12k蛋白结构的相关研究论文,没过几天,第3个团队的相关论文就在《科学》见刊了。
我们未来还将继续挖掘和开发更多小型基因编辑系统,开发衍生的基因编辑相关应用,也会尝试一些遗传疾病和感染疾病治疗方面的一些应用。但要进一步推进我们研究的深度和广度,还 需要有更多不同学科背景的研究者加入我们的研究团队,或者与我们一起合作来推进研究 ,这样才能在今天这种激烈的国际竞争中不落人后。
 季泉江课题组团队成员 | 季泉江课题组提供
季泉江课题组团队成员 | 季泉江课题组提供
论文链接:
https://www.nature.com/articles/s41589-021-00868-6
采访及撰稿:莜柒
编辑:酥鱼
审稿:季泉江课题组
排版:洗碗





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国