衣藻(Chlamydomonas)亦称“单衣藻”。绿藻门,衣藻科。藻体为单细胞,球形或卵形,前端有两条等长的鞭毛,能游动。鞭毛基部有伸缩泡两个;另在细胞的近前端,有红色眼点一个。载色体大型杯状,具淀粉核一枚。无性繁殖产生2、4、8或16个游动孢子;有性生殖为同配、异配和卵式生殖。在不利的生活条件下,细胞停止游动,并进行多次分裂,外围厚胶质鞘,形成临时群体称“不定群体”。环境好转时,群体中的细胞产生鞭毛,破鞘逸出。广布于水沟、洼地和含微量有机质的小型水体中,早春晚秋最为繁盛。1衣藻属是原始的单细胞绿色植物,已被记录的有500多个种2。
简介单细胞,球形或卵形,前端有两条等长的鞭毛,能游动。鞭毛基部有伸缩泡1或2个;在细胞的近前端,有红色眼点一个。色素体常为大型杯状,具一个蛋白核。细胞壁平滑,不具或具胶被。细胞前端中央具或不具乳突状突起。无性繁殖产生2~16个游动孢子;有性生殖为同配、异配和卵式生殖。4
多生活于有机质丰富的小水体或潮湿的土表上。但是池塘、湖泊或河流中也常发现。巢湖常见的浮游种类。4
形态特征植物体为游动单细胞:细胞球形、卵形、椭圆形或宽纺锤形等,常不纵扁;细胞壁平滑,不具或具有胶被。细胞前端中央具或不具乳头状突起,具2条等长的鞭毛。鞭毛基部具1个或2个伸缩泡。具1个大型的色素体,多数杯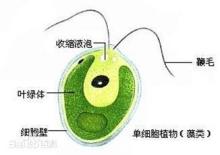
分布范围衣藻属是常见的淡水绿藻。在生长季节里,衣藻常在营养特别是氮、磷较丰富的坑塘中,有时长成纯群,但在池水或缓流中则常与其他藻类等混生,不易采集。在非生长季很难找到它们。6
衣藻属植物不论是在清澈的泉水,还是在污水里都有分布,但大多数种类产于有机质丰富的小水休或潮湿的表土上,一些种类则喜生于酸性的沼泽水体中,如泥炭藓衣藻有的甚至在PH为2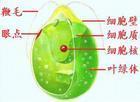
分类情况团藻目(Volvocales)是绿藻门(Chlorophyta)绿藻纲(Chlorophyceae)最大的类群,种类繁多、分布广。衣藻属(Chlamydomonas)是团藻目最大的一个类群,全世界已报道约500种(包括变种)。3
生殖方式生殖方式有无性和有性生殖两种类型。环境适宜时多连续进行无性生殖。无性生殖时,细胞常静止不动,鞭毛收缩或脱落。其内的原生质体经过1~4次有丝分裂,形成2、4、8或16个子原生质体,随后各自形成1个游动孢子,其结构和母体一样。待母细胞壁胶化破裂时,每个游动孢子即被释放出来,并在水中游动,各自长大成1个新个体。衣藻的有性生殖过程也是首先脱去鞭毛,原生质体经过3~6次分裂,产生 8、16、32或64个具2条鞭毛的细胞,叫做配子。其形态结构和游动孢子相同,但更小些。配子释放出来后,成对地进行融合,每对配子产生1个二倍体的合子。合子分泌产生厚壁,经过休眠,当条件适宜时萌发,首先进行减数分裂,各产生4个单倍体的减数孢子。待合子壁破裂后放出孢子,每个减数孢子各形成一个个体。7
模式标本采集在有机质较丰富的池塘或河水中,于春秋雨季,用浮游网采回衣藻样品,如果是小水体或浅水域,最好用碗取水,注人网中过滤,镜检后倒人培养缸内,置于向阳处,不久可见培养缸壁的水表面有一条绿线,这是集聚的衣藻。用吸管自绿线处吸取绿水,可得纯衣藻群种,然后在室内长期培养和保存。2
藻种保存藻种来源于自然水体。在生长季节,找营养丰富含有衣藻细胞的坑塘、池水或缓流取水,带回实验室镜检。确认水样中含有衣藻细胞后,利用其趋光性进行分离提纯。方法是将水样倒人烧杯放在阳面房间见光培养。几小时后在烧杯内水面与杯壁相接处就会有许多游动的衣藻细胞聚集。用吸管从此部位吸取液体放人预先装好培养液的另一烧杯继续培养。此为第一次分离。第一次分离后经3~4天的培养,衣藻细胞通过繁殖由少到多、密度加大,又在水面与杯壁相接处出现聚集的细胞群,此时可进行第二次分离。经过2~3次分离可得到衣藻细胞的纯群,作为藻种。在分离藻种的同时要做好保存藻种的准备。简便易行的方法是:取肥土压碎,挑出碎石和杂物,筛选细面装人100ml或150ml的锥形瓶内,土层厚度为锥形瓶容积的1/4,再注水至容积的3/4处(留有1/4的空间),塞上棉塞,用锅蒸煮30分钟至l小时灭菌,冷却后即可接种。接种时用吸管从游动细胞聚集处吸取正在旺盛生长的衣藻种滴入锥形瓶中,接种量要大一些。接种后把锥形瓶放在阴面房间(15~20℃散射光)存放。由于温度、光照等条件的限制,瓶内细胞新陈代谢缓慢,可保存藻种4~6个月。如继续保存,要进行移种。6
扩大培养为了在实验时能观察到衣藻生活周期的不同阶段,可分二次进行扩大培养(室温在20~25℃时期,实验前8~10天第一次接种,实验前4~5天第二次接种)。把保存的藻种接种到盛有培养液的烧杯中,放在阳面房间见光培养,每天搅拌2~3次用以通气,同时注意补充液体保持杯内液面原有高度。在扩大培养过程中经定量观察,衣藻细胞的消长情况可分五个阶段:6
1. 停滞期:接种后24小时左右。由于藻种从保存液中取出时新陈代谢已处于“走下坡路”状态,同时还要适应新的培养液,所以细胞数量没有明显增加。6
2. 加速期:接种后2~4天。藻细胞经过停滞期的恢复,新陈代谢处于“走上坡路”状态,加之营养、温度、光照等条件适合,无性生殖旺盛,细胞数量迅速增加。6
3. 均衡生长期:接种后约5~7天。由于群体密度加大,营养物质消耗,细胞增殖速度转慢,细胞的死亡和生成处于动态平衡状态,细胞密度波动较小。6
4. 减速期:接种后约8~10天。由于培养液中某些必须元素的耗竭、pH的变化、抑制生长的代谢产物的增加、老化细胞的死亡和自溶,使群体密度很快下降。6
5. 稳定期:约接种10天以后。群体密度减少到一定程度后,又处于低水平的相对稳定状态。6
观察在上述条件下,接种后4~7天的培养液中细胞新陈代谢旺盛、生长繁殖迅速,取材观察可以看到衣藻的营养细胞、孢子囊、孢子、胶群体。6
营养细胞
培养液中个体较大的营养细胞。很多,生理上亦很活跃,在显微镜视野中可以清楚地看到衣藻营养细胞的形态和运动。加碘液染色后观察细胞内的叶绿体、蛋白核、眼点、鞭毛等显微结构也较方便。6
孢子囊和孢子
从培养液细胞聚集处取材可以看到孢子囊和孢子。衣藻孢子囊的产生是在有利条件下开始的,通常在夜间由营养细胞分化形成。细胞的原生质体发生几次连续纵裂,形成4、8或16个孢子,囊壁破裂时释放,形成新个体。6
胶群体
取烧杯底部或壁上的胶状物作装片观察可以看到衣藻的胶群体。在扩大培养过程中,由于培养液内各种条件的变化,部分孢子囊内的各种原生质体不长出鞭毛,连续分裂几次并产生胶质包被,孢子囊壁也胶质化,形成了胶群体状态。条件好转时,胶群体内的细胞各自长出鞭毛,从破裂的囊壁中游出,发育成新个体。6
配子囊和配子
在扩大培养过程中约从减速期开始出现配子囊。配子囊也是由营养细胞形成,其过程与产生孢子囊相似。配子囊内原生质体分裂形成8、16或32个具鞭毛的游动配子,囊壁破裂时放出。配子虽然与孢子形态相似,但其体小且常呈窄椭圆形,仔细镜检观察方可识别。6
合子
从接种10天以后的培养液中取出底部绿色胶状物,装片观察,可见合子的发育。衣藻属合子的发育是一个连续过程。这可人为地分为三个阶段。第一阶段为两个配子融合后形成具四条鞭毛能游动的合子,椭圆形或卵圆形,绿色。第二阶段为合子游动数小时后鞭毛脱落、形态变圆、颜色由绿变为黄绿色。第三阶段为合子原生质体分泌的物质形成次生壁和初生壁上的角突。合子成熟时体积增大或不增大,随种类不同而异,但它们总是积累油类和淀粉而且变成黄红色。合子休眠时间约3一4个月,随种类和生态条件的不同而有差别。合子萌发发生在黑暗的条件下,其过程为2倍体的细胞核发生减数分裂,合子的内壁层分解,带有纹饰的外壁层开裂,放出4或8个单倍体能游动的有性孢子,进而发育成营养细胞。6
研究进展到20世纪40年代至50年代,Lewin、Ruth、Sager以及一些其他人把衣藻的几个种发展成为实验生物体。经过多家实验室的筛选,已经建立了许多株系,其中研究最为广泛是莱哈衣藻(Chlamy-domonasreinhardtii,国内简称之为莱氏衣藻、莱茵衣藻)属的一些株系,衣藻基因组计划(包括全基因组计划及EST计划)选择的也是这种衣藻。现在,全球100多家著名实验室已建立了衣藻实验生物学研究体系及多个研究主题和相应的遗传系统,奠定了衣藻的学术地位。8
衣藻是一种单细胞真核绿藻,素有“绿色酵母”(green yeast)之称。衣藻与酵母有许多共同之处,如生长周期简单,生长快,世代时间短,可以在平板上形成单克隆,也能进行液体培养,以单倍体与二倍体两种形式生长,能对其配子的发育过程进行四分子分析。当然,衣藻也有其独特之处:光照和黑暗条件下均能生长,且能把外界提供的碳源与光合成的碳物质分开;是目前惟一能特异地对线粒体、叶绿体与核分别建立转化系统的生物;显然,在酵母已经奠定了其模式生物的角色以后,再选择一个“绿色”的酵母来作为植物的模式生物,可谓之应运而生,因为许多细胞学问题不可能在酵母中实现,如:光合成(photosynthesis)的途径、生物的机动性(motility)、趋光性(phototaxis)与感光(lightperception)、鞭毛(flagella)、中心粒(centrioles)、轴丝(axoneme)与基体(basalbodies)、植物细胞周期的调控与细胞识别、叶绿体的生物发生(chloroplastbiogenesis)及其遗传(inheritance)、植物细胞的凋亡、叶绿体的转化,以及叶绿体DNA的损伤与修复等。8
衣藻在叶绿体与光合成方面的研究成果最为丰富,利用物理与化学方法筛选、分子遗传学与基因工程手段(如缺失、插入、转座子等方法)创造了大量的有关的突变体,开展了相关的研究。8
本词条内容贡献者为:
王建林 - 教授 - 兰州大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国