泊松-玻尔兹曼方程 (英语:Poisson- Boltzmann Equation)是用来计算电解质溶液中离子浓度和电荷密度分布的一个微分方程。
基本形式其基本形式为(单位为高斯单位制)

其中, 是体系的电势,是溶液的介电常数,
是体系的电势,是溶液的介电常数,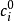 和分别为第
和分别为第 种离子的体相浓度和电荷,
种离子的体相浓度和电荷, , 其中
, 其中 是玻尔兹曼常数。该方程的雏形最早出现于双电层理论的Gouy-Chapman模型中,在这个模型中离子在电极表面附近的分布被认为是遵从玻尔兹曼分布。如今该方程被广泛运用于各种电解质溶液体系性质的计算和分子模拟中,特别是生物体系中各种大分子(例如核酸和蛋白质)在溶液中电荷分布和溶解自由能的计算。
是玻尔兹曼常数。该方程的雏形最早出现于双电层理论的Gouy-Chapman模型中,在这个模型中离子在电极表面附近的分布被认为是遵从玻尔兹曼分布。如今该方程被广泛运用于各种电解质溶液体系性质的计算和分子模拟中,特别是生物体系中各种大分子(例如核酸和蛋白质)在溶液中电荷分布和溶解自由能的计算。
原理泊松-玻尔兹曼方程实际上是通过对体系的平均力势能(Potential of Mean Force, PMF)作平均场近似而得到。从电解质溶液体系的泊松方程出发
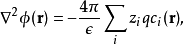
而第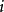 种离子的浓度函数
种离子的浓度函数 可以写成
可以写成
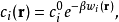
其中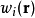 即为第
即为第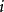 种离子的平均力势能。在平均场近似中,忽略离子间的关联,令平均力势能近似等于该离子的电势能
种离子的平均力势能。在平均场近似中,忽略离子间的关联,令平均力势能近似等于该离子的电势能
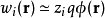 ,
,
即得到泊松-玻尔兹曼方程。
求解泊松-玻尔兹曼方程是一个非线性偏微分方程,除了在特定简化体系(如Gouy-Chapman模型)中能求得解析解外,一般采用数值解法,例如有限差分法或者有限元方法,常用的求解泊松-玻尔兹曼方程的软件包括APBS, Zap, MIBPB, AFMPB等。
当离子的电势能绝对值较小时,即 时,可以把泊松-玻尔兹曼方程中的指数项仅展开到一阶
时,可以把泊松-玻尔兹曼方程中的指数项仅展开到一阶
 ,
,
即可得到德拜-休克尔方程(Debye-Hückel Equation、
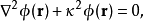
其中 。德拜-休克尔方程是一个线性偏微分方程,易于求解。在稀溶液中,德拜-休克尔方程对于泊松-玻尔兹曼方程而言是很好的近似。
。德拜-休克尔方程是一个线性偏微分方程,易于求解。在稀溶液中,德拜-休克尔方程对于泊松-玻尔兹曼方程而言是很好的近似。
应用与局限泊松-玻尔兹曼方程的优势在于将溶液中的水简化为具有均一介电常数的电介质,这种隐式溶剂(Implicit Solvent)的处理方法极大地简化了生物大分子溶液体系中的模拟和计算。例如,在生物大分子溶液的分子动力学模拟中,体系可以只包含生物大分子,而忽略水分子和其他离子,并采用泊松-玻尔兹曼方程来获得大分子的受力。类似地,对于溶解自由能的计算,来自溶剂的贡献可以使用广义玻恩模型(Generalized Born Model)来处理,而离子的贡献则可以采用泊松-玻尔兹曼方程1。
泊松-玻尔兹曼方程的缺点在于其所使用的平均场近似,当溶液中出现一定浓度高价离子导致离子间相互作用和关联增强,泊松-玻尔兹曼方程的解将无法解释一些由关联所产生的现象,比如带相同电荷的物体在高价盐溶液中相互吸引,以及带电胶体在高价盐溶液中的电泳呈现电荷反转,这些现象必须考虑离子间的关联才能得到合理解释2。
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国