在无水氯化锌存在下,芳烃与甲醛及氯化氢作用,芳烃上的氢原子被氯甲基取代。此反应叫氯甲基化反应。
缩合剂有氯化锌(常用)、氯化铝、氯化锡、硫酸。磷酸或冰醋酸。有时不加缩合剂,盐酸本身即可起缩合剂的作用。
苯、萘、蒽、菲、联苯(三联苯除外)、噻吩、呋喃和它们的衍生物都能发生氯甲基化作用。环上的斥电子基促进反应;吸电子基则阻碍反应的进行。
简介向芳环上直接导入一个氯甲基的反应称为氯甲基化反应。利用苯的氯甲基化反应可制备苄氯,也可将该反应看作一类特殊的傅-克反应。和普通的亲电取代反应一样,当芳环上有第一类取代基(给电子基团)时,反应易 于进行,氯甲基主要进入对位。例如:
Ph—CH3 +H2C═O +HCl —→CH3—Ph—CH2Cl 反应条件:ZnCl2
当芳环上有第二类取代基(吸电子基团)时,反应难以进行,一般不发生氯甲基化。但如果用CH3—O—CH2CI作氯甲基化试剂,反应也可以进行。
萘可以发生类似的反应,氯甲基主要进人萘环α-位。1
反应机理芳烃及其衍生物在ZnCI2存在下与氯甲基化试剂(聚甲醛和氯化氢)作用,芳环上引入氯甲基的反应称为Blanc氯甲基化反应。三聚甲醛-氯化氢、多聚甲醛-氯化氢、甲醛缩二甲醇-氯化氢或甲基氯、氯甲基醚等也是常用的氯甲基化试剂。盐酸、硫酸、磷酸、乙酸等质子酸,氯化铝、氯化锡等Lewis酸也是有效的催化剂。
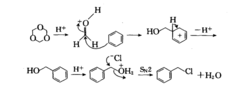
芳环上有烷基、烷氧基等供电子基时有利于反应的进行。但具有多个供电子基的芳烃衍生物往往生成二氯甲基化的副产物。此时最好不加催化剂使反应缓慢进行,以抑制该副产物的生成。酚类、胺类化合物由于具有强供电子基,极易发生此反应,此时若芳环上没有其他钝化基团,往往生成聚合物。因而通常在不加催化剂和降低反应温度的条件下进行,以得到正常产物。芳环上有卤原子、硝基、羧基等吸电子基时会降低产率,其至使反应不能进行。活性较小的化合物常用甲基氯甲基醚、二氯甲基醚或1-氯-4 -(氯甲氧基)丁烷等进行氯甲基化。2
影响因素研究苯乙烯聚合物的氯甲基化反应速度,副交联反应,以及溶剂对反应的影响问题。研究表明,在用氯化锌作催化剂时,反应速率可用一级反应方程表示,比用无水三氯化铝和氯化亚锡作催化剂时的反应速率慢得多,但副交联反应也较少。用无水三氯化铝和氯化亚锡作催化剂时,反应初期也是一级反应,而后就逐渐偏离一级反应规律,若往反应体系中加入二氯乙烷,反应速率下降,而副交联反应速率升高。若以三氯化铝、三氧化二铁、四氯化锡或二氯化锡作催化剂,以二甲基甲醛、磺酰氯和氯磺酸的混合物和苯乙烯聚合体反应,可使氯甲基化反应和副交联反应同时进行祁们。而利用低交联苯乙烯—二乙烯苯共聚体在氯甲基化过程中的副交联反应,可以获得副交联键分布均匀的交联共聚体,这种共聚体就是合成均孔离子交换树脂的骨架。
反应试剂在共聚体中的渗透扩散速率对氯甲基化反应速率影响同样也很大,因此,扩大凝胶孔结构和大孔结构共聚体都比较容易进行氯甲基化反应,如与长链交联剂共聚的苯乙烯共聚体,引入23~25%的氯也是比较容易的。3
应用示例在无水ZnCl2存在下,被氯化物与甲醛混合物通入HCI完成:
C6H6 +HCHO +HCl —→C6H5CH2CI +H2O 反应条件:无水ZnCI2
生成的-—CH2Cl衍生物经水解、氧化反应可生成—COOH衍生物,再与三氯化磷反应可转变为羧酰氯衍生物,进一步与胺类化合物反应生成羧酰胺衍生物。
由于氯甲基在一定条件下可进一步转化为—CH2OH,—CHO,—CH2CN,—CH2NH2及—CH3等基团,故此反应广泛应用于有机合成中。2

本词条内容贡献者为:
程鹏 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国