1811年意大利科学家亚佛加德罗提出:在相同温度和压力下,相同体积的各种气体都含有相同数目的分子,故称亚佛加德罗定律,一摩尔任何气体含有亚佛加德罗分子数,即6.02×1023个,叫做亚佛加德罗常数。精确计算表明,在标准状况下,1摩尔理想气体占有22.414升的体积,称摩尔体积。而真实气体由于分子自身占有体积及分子间相互吸引力,其摩尔体积略有不同1。
概述在物理学和化学中,亚佛加德罗常数(符号:NA或L)的定义是一个比值,是一个样本中所含的基本单元数(一般为原子或分子)N,与它所含的物质的量n(单位为摩尔)间的比值,公式为NA=N/n。因此,它是联系一种粒子的摩尔质量(即1摩尔时的质量),及其质量间的比例常数。亚佛加德罗常数用于代表1摩尔物质所含的基本单元(如分子或原子)之数量,而它的数值为:
在一般计算时,常取6.02×1023或6.022×1023为近似值。
较早的定义中所定的另一个数值为阿伏伽德罗数,历史上这个词与阿伏伽德罗常量有着密切的关系。当国际单位制(SI)修订了基本单位后,所有化学数量的概念都必需被重定义。阿伏伽德罗数的新定义由让·佩兰所下,定为2克分子氢所含的分子数。跟它一样的是,12克同位素碳-12所含的原子数量。因此,阿伏伽德罗数是一个无量纲的数量,与用基本单位表示的阿伏伽德罗常量数值一致。科学家还在不断精确化亚佛加德罗常数,最新的研究论文发现其数值为6.02214082(11)×1023,括号中的数字表示最后两位估值数字的不确定性。
亚佛加德罗常数的定义值是指0.012千克¹²C所含的原子数,6.02×10²³。这个数值是亚佛加德罗常数的近似值,两者是有区别的。亚佛加德罗常数的符号为NA,不是纯数。其单位为/mol。亚佛加德罗常数可用多种实验方法测得,到目前为止测得比较精确的数据是6.0221367×10²³ mol⁻¹,这个数值还会随测定技术的发展而改变。把每摩尔物质含有的微粒数定为亚佛加德罗常数,而不是说含有6.02×10²³个微粒。在定义中引用实验测得的数据是不妥当的,不要在概念中简单地以6.02×10²³来代替“亚佛加德罗常数”2。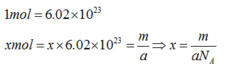
一般用途亚佛加德罗常数是一个比例因子,联系自然中宏观与微观(原子尺度)的观测。它本身就为其他常数及性质提供了关系式。例如,它确立了气体常数R与玻耳兹曼常数kB间的关系式,
以及法拉第常数F与基本电荷e的关系式,
同时,亚佛加德罗常数是原子质量单位(u)定义的一部份,
其中Mu为摩尔质量常数(即国际单位制下的1g/mol)3。
衡量方法亚佛加德罗常数是有量纲的,就是那么一堆东西,那么多粒子就叫1mol。 摩尔就是“一堆”古希腊叫做“堆量”。那么一堆数量就叫一摩尔,它是物质的量的单位,说白了就是粒子“堆”数的单位。相对分子质量的单位是1,当摩尔质量以克每摩尔为单位时,两者数值上相等。
摩尔就是“一堆”古希腊叫做“堆量”。那么一堆数量就叫一摩尔,它是物质的量的单位,说白了就是粒子“堆”数的单位。相对分子质量的单位是1,当摩尔质量以克每摩尔为单位时,两者数值上相等。
方法一
摩尔是表示物质的量的单位,每摩尔物质含有亚佛加德罗常数个微粒。摩尔是国际单位制中的基本单位之一,用于表示物质的量,简称摩,符号为mol。1971年第十四届国际计量大会规定:“摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg¹²C的原子数目相等。使用摩尔时应予以指明基本单元,它可以是原子、分子、离子、电子及其他粒子,或是这些粒子的特定组合。”摩尔好似一座桥梁把单个的、肉眼看不见的微粒跟大数量的微粒集体、可称量的物质之间联系起来了。在化学计算中应用摩尔十分方便。
方法二
亚佛加德罗常数,0.012kg¹²C中所含的原子数目叫做亚佛加德罗常数。亚佛加德罗常数的符号为NA。亚佛加德罗常数的近似值为:6.02×10²³/mol。
符号:NA
含义:1mol任何粒子所含的粒子数均为亚佛加德罗常数2。
本词条内容贡献者为:
王宁 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国