有机反应中速率常数和平衡常数与分子中取代基效应之间的定量关系。这是一类经验的、近似的定量关系。
简介著名的哈米特方程、塔夫脱方程、布仑斯惕酸碱催化定律和斯温方程都属于这种关系。
哈米特方程 1937年美国的L.P.哈米特研究了许多系列芳族化合物的反应速率常数和平衡常数与取代基之间的定量关系。在这些系列化合物中,每个化合物都有一个相同的反应中心,但在该反应中心的间位和对位上,有不同的取代基。哈米特发现,这些化合物中任一个化合物的反应速率常数或平衡常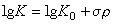 数可用方程 (1)和(1.1)近似算得(如图1):式中k0、K0分别是母体化合物的速率常数和平衡常数;k、K分别是取代的母体衍生物的速率常数和平衡常数;σ为取代常数。表示取代基的吸电子能力或电子能力大小1。
数可用方程 (1)和(1.1)近似算得(如图1):式中k0、K0分别是母体化合物的速率常数和平衡常数;k、K分别是取代的母体衍生物的速率常数和平衡常数;σ为取代常数。表示取代基的吸电子能力或电子能力大小1。
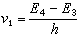 ρ为反应常数,是反应系列对取代基的灵敏度的度量。
ρ为反应常数,是反应系列对取代基的灵敏度的度量。
K、k与ΔF°、ΔF≠的关系可用方程(2)、(3)(如图2和图3)表示:
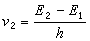
哈米特方程式中ΔF°为反应自由能的变化;ΔF≠为活化自由能的变化;R为气体常数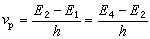 ;k′为玻耳兹曼常数;h为普朗克常数;T为绝对温度。
;k′为玻耳兹曼常数;h为普朗克常数;T为绝对温度。
方程(1)、(1′)可分别写成方程(4)、(4.1)(如图4和4.1): 式中 ΔF孊为母体化合物的反应自由能变化;ΔF嵉为母体化合物的活化自由能变化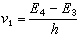 。
。
塔夫脱方程塔夫脱方程50年代R.W.塔夫脱发现:当反应中心不是共轭体系的一个部分,取 代基与反应中心之间的立体效应的程度在反应过程中没有明显变化时,则脂肪族化合物的活性与结构之间的定量关系可以用与哈米特方程相似的方程(如图5)来描述: 式中σ*为极性取代基常数,表示取代基沿脂肪族链传递的吸电子能力。它的值可由方程(如图6)计算:
代基与反应中心之间的立体效应的程度在反应过程中没有明显变化时,则脂肪族化合物的活性与结构之间的定量关系可以用与哈米特方程相似的方程(如图5)来描述: 式中σ*为极性取代基常数,表示取代基沿脂肪族链传递的吸电子能力。它的值可由方程(如图6)计算:  k
k
为取代的乙酸乙酯的水解速率常数;k0为乙酸乙酯的水解速率常数;(k/k0)B为碱催化 (见酸碱催化作用)的速率常数之比;(k/k0)A为酸催化的速率常数之比;ρ*为反应常数。同样,方程(5)可写成方程(如图7):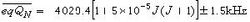 布仑斯惕酸碱催化定律 40年代R.P.贝尔等研究了乙醛水合物的脱水反应后发现,这个反应可由32种羧酸催化,其催化速率常数的对数与酸的酸度常数的对数之间的关系非常接近于线性关系,可用方程(如图8)近似地表示
布仑斯惕酸碱催化定律 40年代R.P.贝尔等研究了乙醛水合物的脱水反应后发现,这个反应可由32种羧酸催化,其催化速率常数的对数与酸的酸度常数的对数之间的关系非常接近于线性关系,可用方程(如图8)近似地表示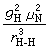 : 式(8)和同它类似的一般碱催化表达式为 S=1/2
: 式(8)和同它类似的一般碱催化表达式为 S=1/2
构成布仑斯惕酸碱催化定律。上式中,kcat是一般酸碱催化速率常数,Ka、Kb分别是酸度常数和碱度常数,a、b分别是直线的斜率和截距。利用方程(2)、(3)、(8)、(9)及有关公式可写成方程I=1/2: 式中N为阿伏伽德罗数。
斯温方程斯温方程C.G.斯温定量地描述了亲核取代反应速率常数与作用物、进攻试剂和溶剂之间的关系(如图11): 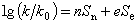 式中n为亲核试剂的亲核性参数;e为亲电试剂的亲电性参数;Sn为反应对亲核电子推的灵敏程度;Se为反应对亲电电子拉的灵敏程度。利用相似的原理,方程(如图11)可写成方程(如图12)
式中n为亲核试剂的亲核性参数;e为亲电试剂的亲电性参数;Sn为反应对亲核电子推的灵敏程度;Se为反应对亲电电子拉的灵敏程度。利用相似的原理,方程(如图11)可写成方程(如图12)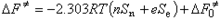 : 由于方程(4)、(7)、(10)、(12)都是自由能的直线方程,把它们统称为线性自由能关系。
: 由于方程(4)、(7)、(10)、(12)都是自由能的直线方程,把它们统称为线性自由能关系。
有机化学中 BEP原理是反应活化能(ΔE)与反应热(ΔH)之间的一种近似的线性关系(如图13),实质上也可归属于线性自由能关系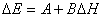 : 式中A、B为常数。线性自由能关系的发现,标志着有机化学中结构与性能之间的关系的研究开始由定性进入到定量的阶段2。
: 式中A、B为常数。线性自由能关系的发现,标志着有机化学中结构与性能之间的关系的研究开始由定性进入到定量的阶段2。
本词条内容贡献者为:
王宁 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国