Kumada反应是镍催化的格氏试剂与卤代烃的交叉偶联反应。
1960年,Chat和Shaw等发现,镍卤化物与格氏试剂能发生金属交换反应(Transmetallation),生成二芳基镍。
作为第一个Pd或Ni催化的交叉偶联反应,由于可以直接使用简便、经济的格氏试剂,Kumada偶联被用于苯乙烯衍生物的工业规模化生产,也是非对称联芳合成经济、方便的首选方法。
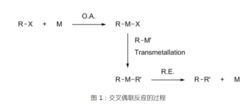
简介交叉偶联反应(Cross-coupling reaction)是在金属催化剂催化下,RX(X=卤素、OTf、磷酸酯等离去基团,R=烯基、联烯基、烯丙基、苄基、炔基等)与金属试剂形成C-C键的反应。从基元反应角度讲,是RX与低价过渡金属催化剂发生氧化加成,使R-X键断裂生成R-M-X,R-M-X再与金属试剂R'-M'发生金属交换反应生成RMR',RMR'经还原消除在R与R'间形成一新的键,同时再生过渡金属催化剂的反应过程。
从20世纪70年代至今已经诞生了许多著名的交叉偶联人名反应,包括Kumada反应、Suzuki反应、Stille反应、Negeshi反应、Sonogashira反应、Heck反应等。
Kumada反应是镍催化的格氏试剂与卤代烃的交叉偶联反应。1960年,Chat和Shaw等发现,镍卤化物与格氏试剂能发生金属交换反应(Transmetallation),生成二芳基镍**。**
10年后的1970年,Uchino等发现,二芳基镍可与卤代烃反应生成一芳基镍卤化物,而使原来配合物中两个连在镍上的芳基间形成C-C键,从而生成了R-R'。
设想如果将这两个反应进行加合,将镍配合物作为催化剂,卤代烃与金属镁试剂即可发生偶联反应形成C-C键,这就是Kumada反应的设计思想。实验结果确实证明了此设计思想的合理性。1972年,Corriu等也发表了类似的工作报道。由此揭开了交叉偶联化学的序幕。这一反应称为Kumada交叉偶联或Kumada-Corriu交叉偶联。此反应的溶剂一般为乙醚或四氢呋喃,但一般来说乙醚比四氢呋喃好,反应温度从0℃到回流均可,所用催化剂一般为带有双齿膦配体的镍配合物,如Ni(dppb)Cl2。反应通式如图。1

反应优点一是即使在低温下反应也容易进行,二是可直接使用格氏试剂,而无需转化成其他有机金属试剂。缺点是由于格氏试剂碱性和亲核性强,能与许多官能团反应,因而不适用于在格氏试剂存在下不稳定的卤代烃。1
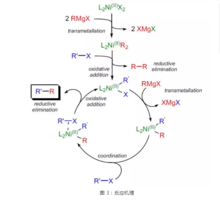
反应原理催化循环过程如图所示:二价镍催化剂前体L2NiX2与格氏试剂发生金属交换反应,生成具有催化活性的物种——二芳(烯)基镍配合物L2NiR2,此配合物与卤代烃发生反应,生成一芳(烯)基镍配合物L2NiR'X进入催化循环,一芳(烯)基镍配合物与格氏试剂发生金属交换反应,生成交叉的二芳(烯)基镍配合物L2NiRR',后者与卤代烃配位,Ni向C-X键反馈,促使二芳(烯)基镍配合物L2NiRR'发生还原消除,释放出产物RR',同时氧化加成插入R'-X中,回到一芳(烯)基镍配合物L2NiR'X,完成催化循环。
烯基卤化物的双键在一般情况下其构型不发生变化,是一个立体专一性的反应(Stereospecific reaction)。

但对于格氏试剂中的碳-碳双键情形则不同,如Z式的2-苯乙基溴化镁在镍配合物存在下与芳基卤代烃发生偶联反应,生成了Z、E异构体的混合物,其原因是格氏试剂中的碳-碳双键与镍发生作用,导致顺式双键异构化为热力学上更稳定的反式烯基格氏试剂。2
应用举例作为第一个Pd或Ni催化的交叉偶联反应,由于可以直接使用简便、经济的格氏试剂,Kumada偶联被用于苯乙烯衍生物的工业规模化生产,也是非对称联芳合成经济、方便的首选方法。
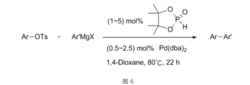
通过改变配体,利用Ni-Mg双金属的协同作用,Beller、Nakamura和Althammer分别发展了不活泼的氯代烷、氟代烷和非活化对甲苯磺酸酯参与的Kumada偶联,拓展了Kumada偶联的适用范围。
Buchwald曾报道过在适当膦配体存在下,可实现官能化的Knochel型格氏试剂在低温下与芳基苯交叉偶联。
值得一提的是,在空气中稳定的PinP(O)H可以作为配体的前体使用。
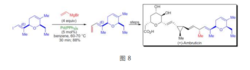
Y.Kobayashi等人在进行天然产物四氢大麻酚及其类似物全合成的最后阶段应用了Kumada偶联反应,反应底物是磷酸烯醇酯。

E.N.Jacobsen课题组在抗真菌药物安布替星的不对称全合成中应用了Kumada偶联反应,得到双键构型完全保持的共轭二烯结构。2
本词条内容贡献者为:
耿彩芳 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国