化学反应速率方程是利用反应物浓度或分压计算化学反应的反应速率的方程。
而化学反应速率通常指的是单位时间内反应物浓度的减少或生成物浓度的增加。根据时间的长短,单位时间可用s、min、hr、day、year等不同单位表示,它由反应的快慢而定。
化学反应速率方程直接计算得出的是特定浓度下的瞬时速率,由方程两边积分得出的才是平均速率。
简介对于一个化学反应 ,化学反应速率方程1(与复杂反应速率方程相比较)的一般形式写作:
,化学反应速率方程1(与复杂反应速率方程相比较)的一般形式写作:

在这个方程中,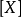 表示一种给定的反应物
表示一种给定的反应物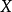 的活度,单位通常为摩尔每升(
的活度,单位通常为摩尔每升(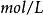 ),但在实际计算中有时也用浓度代替(若该反应物为气体,表示分压,单位为帕斯卡(
),但在实际计算中有时也用浓度代替(若该反应物为气体,表示分压,单位为帕斯卡(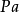 )。
)。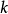 表示这一反应的速率常数,与温度、离子活度、光照、固体反应物的接触面积、反应活化能等因素有关,通常可通过阿累尼乌斯方程计算出来,也可通过实验测定。
表示这一反应的速率常数,与温度、离子活度、光照、固体反应物的接触面积、反应活化能等因素有关,通常可通过阿累尼乌斯方程计算出来,也可通过实验测定。
指数 、
、 为反应级数,取决于反应历程。在基元反应中,反应级数等于化学计量数。但在非基元反应中,反应级数与化学计量数不一定相等。
为反应级数,取决于反应历程。在基元反应中,反应级数等于化学计量数。但在非基元反应中,反应级数与化学计量数不一定相等。
复杂反应速率方程可能以更复杂的形式出现,包括含多项式的分母。
上述速率方程的一般形式是速率方程的微分形式,它可以从反应机理导出,而且能明显表示出浓度对反应速率的影响,便于进行理论分析。将它积分便得到速率方程的积分形式,即反应物/产物浓度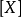 与时间
与时间 的函数关系式。
的函数关系式。
质量作用定律在空气中即将熄灭的余烬的火柴,放到纯氧中会复燃。
说明浓度大的体系,活化分子组的数目比浓度小的体系多,有效碰撞次数增加,反应加快,结果,余烬的火柴复燃。
在基元反应中,或在非基元反应的基元步骤中,反应速率和反应物浓度之间,有严格的数量关系,即遵循质量作用定律。
恒温下,基元反应的速率同反应物浓度幂的连积成正比,幂指数等于反应方程式中的化学计量数,这就是质量作用定律,上式也叫做速度定律表示式。
反应速率方程的定义质量作用定律的表达式,经常称为反应速率方程2,速率方程中,[A] 表示某时刻反应物的浓度,vi 是以物质 i 的浓度表示的反应瞬时速率,即反应物为 [A] 时的瞬时速率。
ki 是速率常数,在反应过程中不随浓度变化,但 ki 是温度的函数,不同温度下,ki 不同。
a 和 b 之和,称为这个基元反应的反应级数,可以说该反应是 (a+b) 级反应。也可以说,反应对 A 是 a 级的,对 B 是 b 级的。
在基元反应中,由 a 个 A 分子和 b 个 B 分子,经一次碰撞完成反应,我们说,这个反应的的分子数是(a+b),或说这个反应是(a+b)分子反应。
只有基元反应,才能说反应分子数,在基元反应中,反应级数和反应分子数数值相等,但反应分子数是微观量反应级数是宏观量。
速率方程的确定速率方程的确定3主要有以下三种方式:
微分法:对 求对数,得到:
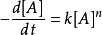
 ,然后取若干个不同的初始浓度
,然后取若干个不同的初始浓度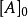 ,然后分别从
,然后分别从 上求出相应的斜率
上求出相应的斜率 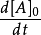 ,求出
,求出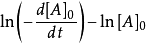 直线的斜率,并进一步求出反应物
直线的斜率,并进一步求出反应物 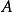 的反应级数。
的反应级数。
2. 尝试法/试差法:分别将某一化学反应的 和
和 代入各种级数反应的积分速率方程,看哪一个最准确。
代入各种级数反应的积分速率方程,看哪一个最准确。
3. 半衰期法:求得两个不同初始浓度下的反应半衰期,然后根据总结一节中的半衰期通式,求出反应级数。
本词条内容贡献者为:
尹维龙 - 副教授 - 哈尔滨工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国