超强酸是一类酸性比浓硫酸还强的酸。世界上已开发和研制了比硫酸、盐酸、硝酸酸性强几百万倍,甚至几十亿倍的超强酸。以HSO3F-SbF5为例,超酸比100%硫酸强1019倍。
碱强度超过强碱(即pKa>26)的碱为超强碱。有布仑斯惕超强碱,路易斯超强碱。有固体、液体两类超强碱。用于催化某些化学反应的超强碱为超强碱催化剂。
超强酸与超强碱合称超强酸碱。
超强酸含义超强酸又称为超酸,英文名称为super acid。它比一般的强酸如硫酸、盐酸的酸性强几个数量级。物质的量为1:0.3的氢氟酸和五氟化锑混合时的酸性强度要比无水硫酸(100%)的强度强约大1亿倍。
而HF~SbF5的物质的量比1:1(氟锑酸)时其酸性估计可达无水硫酸的1019倍,是已知最强的超强酸。这些超强酸如魔酸,它是五氟化锑和氟磺酸按体积比1:1混合制成的混酸。其酸度只是无水硫酸的1000万倍,在世界市场上已有商品出售,超强酸在化学和化学工业上,有很大应用价值,它既是无机及有机的质子化试剂,又是活性极高的催化剂。过去很多在普通环境下极难实现或根本无法实现的化学反应在超强酸环境中。却能异常顺利地完成。
这里需要指出的是,人们常说的“王水”,其实质是一种混合腐蚀剂,而不是酸,它的腐蚀作用的原理是高浓度的原子态氯,配合高浓度的氯离子,这使得常态下很稳定的贵金属在其中能够顺利参与反应,从而被腐蚀。故而王水的溶解能力和真正意义的酸性是两码事。在中学课本中,金属的活泼性被划分为“氢前金属”和“氢后金属”,这是针对金属和非氧化性强酸水溶液反应的活性而言。但是现实情况要更复杂些,一些很强的非氧化性强酸能跟银这样的贵金属发生反应,例如浓盐酸和浓氢碘酸,这不仅仅因为其水溶液有很高浓度的水合氢离子,而且和其阴离子的络合能力有关——但这些“特例”仍然在常规意义的“酸”的范畴。
直到有一天奥莱教授和他的学生偶然发现了一种奇特的溶液,它居然能溶解不溶于王水的高级烷烃蜡烛,人们才知道通常人们所知道的几大强酸都还不算什么,还有比它们强得多的酸,人们称之为“超强酸”,其中包含魔酸,也就是氟锑磺酸。1
分类a.布朗斯特超酸,如HSO3Cl、HSO3F和HSO3CF3等,室温下为液体,本身为酸性非常强的溶剂。
b.路易斯超酸:SbF5、AsF5、AuF5、TaF5和NbF5等,其中除却AuF5外,氟锑酸是已知最强的路易斯酸,可用于制备正碳离子和魔酸等共轭超酸。
c. 共轭布朗斯特——路易斯超酸:包括一些由布朗斯特和路易斯酸组成的体系。如:H2SO4·SO3(H2S2O7);H2SO4·B(OH)3;HSO3F·SbF5;HSO3F等。
d. 固体超酸:硫酸处理的氧化物TiO2·H2SO4;ZrO2·H2SO4;路易斯酸处理的TiO2·SiO2等。
用途a. 非电解质成为电解质,能使很弱的碱质子化(碳正离子)
b. 超酸中,解离出多卤素阳离子I2+、I3+、Br2+、Cl2+等
c. 良好的催化剂
d. 使用超酸可以活化碳氢化合物,最近的例子是六氟合锑酸溶液中对甲基环戊烷的羰基化反应。对C-H键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排并未给出)对C-C碱的质子化在经重排后产生了一个线性的碳正离子(其他的异构体并没有给出)。加入的CO捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物。

超强碱含义超强碱就是碱性较强的物质。超强碱尚没有明确的定义,但大部分化学家以氢氧化钠作为强碱和超强碱的界限。超强碱的例子有格林尼亚试剂、氮化锂、氢化钠、氢化钙等。
大多数超强碱是具很强脱质子能力的负离子,这些负离子必须存在于某种溶液体系或者是离子化合物中,因此需要特有的惰性阳离子(即碱根阳离子)与其配对,而大多数金属阳离子会与强碱发生路易斯酸碱反应,形成稳定的酸碱对而降低超强碱的活性,对于碱性较弱的阴离子超强碱,一般采用惰性阳离子与之形成盐型化合物,如:LiNH2晶体、NaCHF2晶体。而碱性更大的超碱甚至会和传统意义上的惰性阳离子发生配位,造成其在极性溶剂中的溶解度下降或者碱的活性下降,此时可以构造一些配位阳离子作为其碱根阳离子。
举例施洛瑟碱(Schlosser碱):施洛瑟碱是一种超强碱,由烷基锂及醇钾混合而成。最常见的施洛瑟碱是正丁基锂与叔丁醇钾的混合物。
因为锂和醇基中氧的亲和力,正丁基锂和叔丁醇钾交换阳离子成为正丁基钾及叔丁醇锂,而正丁基锂的锂被钾置换后,使得正丁基的离子性变强,因此整体的碱性也随之增加。施洛瑟碱的命名是纪念其发现者曼弗雷德·施洛瑟。
类施洛瑟碱:类施洛瑟碱的原理和施洛瑟碱类似,是利用交换阳离子的原理生成一个碱性较弱的路易斯加合物,并释放惰性更大的阳离子和活性更强的碱性阴离子。例如:芳香基银的甲苯溶液中加入二异丙基亚氨基铯,因为银和亚胺基氮的亲和力,芳香基银和二异丙基亚氨基铯交换阳离子形成芳香基铯和二异丙基亚氨基银(如果二异丙基亚氨基铯过量则还会生成Cs[AgN2(R2)2]络合物),同样使芳香基离子性变强,体系碱性增强。AgB2H5的Si4H10溶液中加入二异丙基亚氨基铯将会爆炸。
分类固体超强碱
三甲基硅烷基氯化镁、AgB2H5、LiB2H5是能够以溶液的形式存在的最强碱,但如果说三甲基硅烷基氯化镁、AgB2H5、LiB2H5是普遍意义上的最强碱,那还差之甚远。固体超强碱,如Li4C、Mg2Si、Na3B(硼化三钠)等,其对应的共轭酸pKa值往往超过120,甚至达到150-160。他们的碱性强到几乎不能够以溶液形态存在。例如:Na3B溶解于丁硅烷Si4H10会发生配位反应,生成[(Si4H10)B4]12-而后析出氢化钠形成硼硅加合物。另外有些碱如Li3N、Ag3N等,难溶于大多数有机溶剂,却能在固相中发生很强的碱性反应。他们也被称为固体超强碱。2
液体超强碱
过去一般认为,三甲基硅烷基氯化镁[Me3SiMgCl]是已知的能以溶液形式存在的最强的碱。其对应的共轭酸为三甲基硅烷[Me3SiH],其pKa=70。用一倍物质的量的硅化镁固体和三倍物质的量的一氯甲烷反应可以制得三甲基硅烷基氯化镁。反应如下:
3CH3Cl + Mg2Si = (CH3)3SiMgCl + MgCl2

用三甲基硅烷液体作为溶剂,溶解提取出生成的三甲基硅烷基氯化镁,即得到20%-40%的碱液。
从组成上来看,可以认为这是一种格氏试剂。
氟化银和B2H4反应得Ag[BH2F]2,再与LiH缓慢作用,制得AgB2H5。其结构如右图所示:
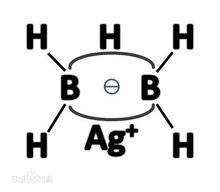
AgB2H5相当于银原子取代了乙硼烷中位于氢桥键上的氢原子的位置。一价银离子离去后,剩下一个二中心二电子的“孤电子对桥”,它极易结合一个质子形成其共轭酸——乙硼烷。乙硼烷的pKa=110,事实上B2H6中的氢已经带有负电荷,B2H5-和质子这个反应相当于氧化还原反应。
AgB2H5只存在用丁硅烷(Si4H10)作为溶剂的溶液中。B-Ag-B为离子性很强的共价结构。低温下稳定,常温下易爆炸分解为单质银、氢气及高级硼氢化合物。
理论上来说,氢化锂和B2H4反应会直接制得LiB2H5,为离子化合物。这种化合物碱性较强,活性极大。其丁硅烷溶液是最强的碱性溶液之一。
本词条内容贡献者为:
王强 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国