在有机合成中,常常使用溶解金属或某些合金来还原有机化合物。常用的金属有碱金属,如锂、钠、钾;碱土金属,如钙、镁、锌以及铝锡、铁等金属。使用的合金多为金属与汞的合金,如钠汞齐、锌汞齐、铝汞齐等。钠汞齐降低了活泼金属的活性,而铝汞齐则提高了汞的活性。
在这些还原反应中,或者在反应时就存在有给质子体,或者在反应后再用质子给予体处理。提供质子给予体的经常是乙醇、异丙醇、叔丁醇或水。
简介溶解金属的还原是活泼金属和羟基溶剂释放出的“新生态氢”与被还原分子进行还原反应。事实上,还原时产生氢气是一个不利的、不希望发生的副反应。溶解金属还原本质是“内部的”电解还原。在这一过程中,一个电子从金属表面(或从溶液的金属)转换到待还原的有机分子上,或者这个电子也可能从某些金属较低价态的离子转移出来到被还原的有机分子中,使其成为“负离子自由基”,这时如遇到供质子剂即取得质子而成为自由基,自由基再从金属表面取得一个电子,则形成负离子,负离子再从供质子剂取得质子而完成还原反应。
若负离子自由基形成后,不遇到供质子剂,则可以二聚成为双负离子,此时再与供质子剂相遇,就形成“双分子还原”的产物。因此这类还原的本质是金属提供电子,形成负离子自由基,还原反应必须有供质子试剂存在。如酮的还原,其过程可表示如下,反应中金属的电子迁移到羰基上,分两步进行:1
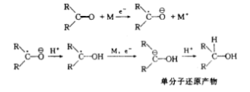
一般来说,反应主要生成立体异构体中最稳定的一种醇。
一般的溶解金属还原溶解金属还原可还原许多官能团。用得最多的是羰基、酯基、硝基及芳核化合物的还原。醛酮的羰基可通过与各种金属在质子溶液中反应被还原,醛被还原为伯醇,酮被还原为仲醇。还原酮的较方便的方法之一是使用钠和异丙醇在甲苯中回流。用金属进行酮的还原反应具有立体化学上的优点,即较稳定的醇经常是(但并不总是)主要产物。
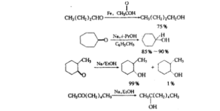
酯基一般被还原为醇。在LiAlH4出现前,用金属钠一醇将酯还原为一级醇是最常用的方法,非共轭的碳碳双键一般对这些还原条件是惰性的。用金属还原的优点之一是它能选择性地还原二酸的单酯的酯基部分。羧酸盐一般不能被碱金属的液氨溶液还原。然而锂在较高沸点的溶剂—甲胺或乙胺所形成的溶液中也可将羧酸盐还原为醛的衍生物。
但这些反应常常由于发生竞争的Dieckmann关环反应,或在水解之前存在烯二醇双负离子的不稳定性而复杂化。这个问题可用下述方法得到部分解决:使二元酸酯在三甲基氯硅烷存在的情况下进行羟酮缩合反应,生成比较稳定的烯二醇,双-硅烷醚,后者经分离和随后用酸性水解仰得到羟基酮。三甲基氯硅烷也能迅速地与羟酮缩合中生成的金属烷氧基化合物作用而除去这些破,这些碱正是竞争的Dieckmann关环反应的催化剂。2
碱金属在液氨或胺中的还原碱金属的液氨溶液用来还原共轭双烯、α,β-不饱和酮、苯乙烯类化合物及苯环这样一些具有共轭体系的化合物。还可以作为氢解试剂对芳醚、硫醚等化合物进行氢解。对于具有双取代的块键,也可立体选择性地将叁键部分还原为相应的反式烯烃,成为炔键催化氢化的补充方法。催化氢化主要生成顺式的烯烃。
Birch还原的主要用途是将芳香族化合物还原成脂肪族化合物,而且不同于催化氢化,还原产物不是饱和的脂肪族化合物,而是1,4-二氢术生物,这种六元脂环衡生物是合成很多天然产物的原料,已广泛用于萜类、甾体、生物碱和某些昆虫激索的合成。碱金属如锂、钠、钾等可以在液氨中溶解,形成金属离子和“溶剂化的电子”。这种溶剂化的电子具有很强的还原能力。除液氨外,有机胺如甲胺、乙胺、二甲胺等对有机物有较大的溶解能力和较高沸点,因此也可作为效果更好的溶剂,有利于反应开始阶段的进行。在碱金属中锂在液氨中的溶解度最大,钾次之,钠的溶解度最小。反应中必须加供质子剂如醇、水等。
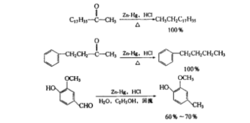
锌汞齐盐酸还原锌汞齐-盐酸可将羰基还原为亚甲基,是专用还原剂,这就是著名的Clemmensen还原反应。一般使用浓盐酸做溶剂,一些对酸敏感的化合物,不宜用此法还原。由于羰基化合物在浓盐酸中溶解度不好,所以常加共落剂如乙酸、乙醇、二氧六环或其他惰性溶剂,在反应中,其羰基被锌汞齐和盐酸还原为亚甲基。
酮类Clemmensen还原的主要对象,产率往往比较多。例如:
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国