中心原子与配体以配位键结合形成配位化合物的内界,内界一般带电荷,带电荷的内界也称配离子,配离子与带相反电荷的离子(外界)结合形成配位化合物。配离子可带正电荷也可带负电荷。
定义配离子的电荷数等于中心原子和配体总电荷的代数和。1
举例例如,在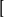 Cu(NH3)4
Cu(NH3)4 中,NH3是中性分子,所以配离子的电荷就等于中心原子的电荷数+2。 而在
中,NH3是中性分子,所以配离子的电荷就等于中心原子的电荷数+2。 而在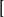 HgI4
HgI4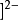 中,配离子的电荷数=1 x ( +2) + 4 x ( -1)= - 2 。1
中,配离子的电荷数=1 x ( +2) + 4 x ( -1)= - 2 。1
应用由于配合物是电中性的,因此,外界离子的电荷总数和配离子的电荷总数相等,而符号相反,所以由外界离子的电荷可以推断出配离子的电荷及中心原子的氧化值。例如,K4[Fe(CN)6]中 ,外界离子的电荷总数=4x(+1)= + 4,所以其配离子的电荷为 - 4 ,可以推出中心原子铁的氧化值为Fe(II)。2
知识拓展配合物的定义为了说明什么是配合物,我们先看一下向硫酸铜溶液中滴加过量氨水的实验。 在盛有硫酸铜溶液的试管中滴加氨水,边加边摇,开始时有大量天蓝色的沉淀生成, 继续滴加氨水时,沉淀逐渐消失,得深蓝色透明溶液。 若向这种深蓝色溶液中加入NaOH溶液,无天蓝色氢氧化铜沉淀生成,但若向该溶液中加入少量氯化钡溶液时,则有白色硫酸钡沉淀析出。这说明溶液中存在着硫酸根离子, 却几乎检査不出铜离子。
往深蓝色溶液中加入乙醇,立即有深蓝色晶体析出。经 X 射线分析,该深蓝色结晶的化学组成是[Cu(NH3)4]S04 ·H20。它在水溶液中能够完全解离为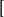 Cu(NH3)4
Cu(NH3)4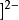 和硫酸根离子 ,而前者是由1个铜离子和4个氨分子相互结合形成的复杂离子。这类复杂的离子称为配位个体。
和硫酸根离子 ,而前者是由1个铜离子和4个氨分子相互结合形成的复杂离子。这类复杂的离子称为配位个体。
通常把具有空轨道的中心原子或阳离子与可以提供孤电子对的配位体(可能是阴离子或中性分子)以配位键形成的不易解离的复杂离子(或分子)称为配位个体。配位个体可以是中性分子,也可以是带电荷的离子。不带电荷的中性配位个体也称配位分子,它本身就是配合物。带电荷的配位个体称为配离子,其中带正电荷的配位个体称为配阳离子;带负电荷的配离子称为配阴离子。
由带电荷的配位个体所形成的相应化合物及中性配位个体统称为配合物(习惯上把带电荷的配位个体也称为配合物)。如[Cu(NH3)4]S04是配合物。1
配合物的组成配合物由内界和外界两部分组成。内界为配合物的特征部分(即配位个体),是一个在溶液中相当稳定的整体,在配合物的化学式中以方括号标明。方括号以外的离子构成配合物的外界,内界与外界之间以离子键结合。内界与外界离子所带电荷的总量相等,符 号相反。显然,中性配位个体只有内界,没有外界。以[Cu(NH3)4]S04为例,其组成可表示为1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国