公式原理
设想向一个系统供热,系统的温度就要上升,这表明,系统的内能增加了, 其增加的量当然就等于系统吸收的热量: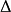 U=Q;在设想对一个系统做功,系统的内能也增加了,其增加量当然就等于环境向他做的功:
U=Q;在设想对一个系统做功,系统的内能也增加了,其增加量当然就等于环境向他做的功: U=W;若即向系统做功, 又向系统供热,系统内能的增加量等于环境向他做的功,系统内能的增加就等于吸收的热量与环境向系统做功的总和:
U=W;若即向系统做功, 又向系统供热,系统内能的增加量等于环境向他做的功,系统内能的增加就等于吸收的热量与环境向系统做功的总和:
系统与环境的能量交换的方向可以倒过来,系统放热、系统向环境做功或者系统即向环境放热又向环境做功,这个关系式是否成立?或者,系统向环境放热的同时环境向系统做功,或环境向系统供热的同时系统向环境做功呢?这个关系时都同样成立。总之,这个关系式概括了一个客观事实:能量及不可能无缘无故地产生,也不会无缘无故地消失,只会从一种形式转变为另一种形式, 这就是热力学第一定律,因而下式被称为热力学第一表达式: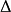 U=
U=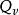
以上分析表明,热力学定律是对客观事实进行概括得出的结论。
我们来化学反应的内能变化。
例如:在298.15K 下按方程式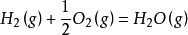 发生1mol 反应,总共放出多少热?
发生1mol 反应,总共放出多少热?
无法回答。因为没有给定从始态(反应物)到终态(生成物)两个状态的温度、体积和压力等状态函数。如果给定终态温度仍为298.15K,即发生等温过程,还不能回答,要看系统的体积或压力是否改变。如果再给定始态和终态 系统的体积不变,即反应在一个刚性器壁的容器里进行,即发生等温等容过程, 我们才能进行实际测定和理论计算。
可以通过实验来测定反应热效应。测定等温等容反应热效应使用的实验仪器叫做“燃烧弹”(又叫氧弹,因燃烧通常指物质与氧反应)。燃烧弹是一个封闭系统,当用电热丝触发反应发生(电热丝共给的能量因相比与反应发生放出 的能量变化太小,可忽略不计),系统的温度迅速升高,设燃烧弹具有刚性壁,容积一定,系统与环境之间没有发生功交换,若系统温度恢复到298.15K,在等温等容下化学反应的内能变化就完全以热的形式传递给环境。于是可得到: U=
U=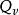
式中Q的下标“V”是表明这种热效应是在系统发生等容过程是测定的,这种热效应称为等容热效应。这个式子表明:当化学反应在等温等容下发生,系统与环境没有功交换(包括膨胀功和有用功),反应热效应等于反应前后系统的热力学能(内能)的变化量。
经测定,发生上述1mol 反应,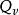 =-240.580kJ/mol(单位中加了“/mol” 是表示按上述化学方程式发生1mol 反应释放的热量)。为此,我们用下式来表示这个反应的内能变化:
=-240.580kJ/mol(单位中加了“/mol” 是表示按上述化学方程式发生1mol 反应释放的热量)。为此,我们用下式来表示这个反应的内能变化:
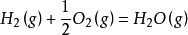
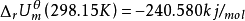
符号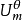 (298.15K)中的下标“r”是反应(reaction)的意思,“m”是发生1mol 反应(molar reaction)的意思,上标“
(298.15K)中的下标“r”是反应(reaction)的意思,“m”是发生1mol 反应(molar reaction)的意思,上标“ 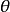 ”表明反应是在热力学标准状态(thermodynamic standard state)下进行的,括号内给出了这个等温过程的温度,因而符号
”表明反应是在热力学标准状态(thermodynamic standard state)下进行的,括号内给出了这个等温过程的温度,因而符号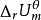 的全名应该是标准摩尔反应的能量变化,或反应内能变化。
的全名应该是标准摩尔反应的能量变化,或反应内能变化。
需要注意的是,如果我们把上述反应写成如下形式,则:
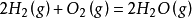
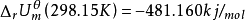
因为这时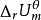 中对应的1mol反应是2mol
中对应的1mol反应是2mol 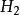 与1mol
与1mol 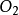 反应得到2mol
反应得到2mol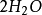 (气)。
(气)。
诺燃烧弹内发生一个吸热反应,上式同样成立,所不同的是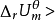 0。也就是说,当系统恢复到反应前的温度时,系统要从环境吸收相当于反应物变成生成物内能减少的热量。总之,化学反应的热力学能变化(内能变化)
0。也就是说,当系统恢复到反应前的温度时,系统要从环境吸收相当于反应物变成生成物内能减少的热量。总之,化学反应的热力学能变化(内能变化)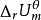 的具体数值是与化学方程式一一对应的,所谓“对应”,不仅指发生什么反应, 而且指怎样书写化学方程式。2
的具体数值是与化学方程式一一对应的,所谓“对应”,不仅指发生什么反应, 而且指怎样书写化学方程式。2
内能改变影响内能的因素有温度、物体内部分子的多少、种类、结构、状态等.
做功和传热能改变热力学内能。3
外界对物体做功,或者物体从外界吸收热量,物体的内能增加;反之,物体对外界做功,或者物体向外界放出热量,物体的内能减少。常见的对物体做功的四种方法:①压缩体积,物体的内能增加,如打气筒打气;②摩擦生热,物体的内能增加,例钻木取火;③锻打物体,物体内能增加,如发令枪响;④拧弯物体,物体的内能增加,如来回多次拧弯金属丝。4
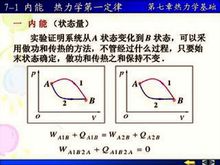
具体改变途径如下图一。

不同形式的能量(如内能和机械能、化学能和内能)之间可以相互转化。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国