简介
节流膨胀过程(Throttling Expansion Process)是指在较高压力下的流体(气或液)经多孔塞(或节流阀)向较低压力方向绝热膨胀过程。
大气中作垂直运动的气块的状态变化通常接近于绝热过程。气块上升,外界气压逐渐降低,气块体积膨胀作功消耗内能而降温,叫“绝热冷却”;气块下沉,外界气压逐渐加大,气块体积因外力作功被压缩,使其内能增加而升温,叫“绝热增温”。1
节流膨胀原理高压气体经过小孔或阀门受一定阻碍后向低压膨胀的过程。
1852年,焦耳和汤姆逊设计了一个节流膨胀实验,使温度为T1的气体在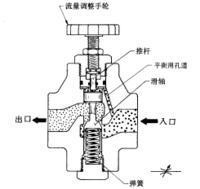 一个绝热的圆筒中由给定的高压p1经过多孔塞(如棉花、软木塞等)缓慢地向低压p2膨胀。多孔塞两边的压差维持恒定。膨胀达稳态后,测量膨胀后气体的温度T2。他们发现,在通常的温度T1下,许多气体(氢和氦除外)经节流膨胀后都变冷(T2p2.由于多孔塞的孔很小,气体只能缓慢地从左侧进入右侧,从p1到p2的压力差基本上全部发生在多孔塞内,由于多孔塞的节流作用,可保持左室p1部分和右室低压p2的部分压力恒定不变,即分别为p1与p2.这种维持一定压力差的绝热膨胀过程叫做节流膨胀。
一个绝热的圆筒中由给定的高压p1经过多孔塞(如棉花、软木塞等)缓慢地向低压p2膨胀。多孔塞两边的压差维持恒定。膨胀达稳态后,测量膨胀后气体的温度T2。他们发现,在通常的温度T1下,许多气体(氢和氦除外)经节流膨胀后都变冷(T2p2.由于多孔塞的孔很小,气体只能缓慢地从左侧进入右侧,从p1到p2的压力差基本上全部发生在多孔塞内,由于多孔塞的节流作用,可保持左室p1部分和右室低压p2的部分压力恒定不变,即分别为p1与p2.这种维持一定压力差的绝热膨胀过程叫做节流膨胀。
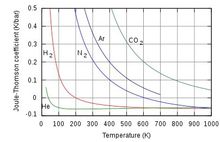
焦耳-汤姆逊系数不同气体在大气压下的焦耳-汤姆逊系数,如下图。
焦耳-汤姆逊(开尔文)系数可以理解为为在等焓变化的节流膨胀中(或是焦耳-汤姆逊作用下)温度随压力变化的速率。表达式如下:
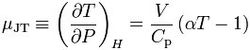
V——表示气体体积;
Cp——表示该气体的等压热容;
α——表示该气体的热膨胀系数。
μJT的国际单位是K/Pa,通常用°C/bar。
当μJ.T是正数是,则气体降温,反之则升温。大气压下焦耳汤姆逊效应中氦气和氢气通常为升温性质的气体,而大多数气体则是降温,对于理想气体焦耳汤姆逊系数为零,在焦耳汤姆逊效应中既不升温也不降温。
下面我们来推导这个表达式:2
前提一:焦耳汤姆逊效应是一个绝热不可逆过程容易推导得出这是一个等焓过程,则dH=O。
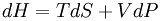
前提二:由基础热力学关系式(将dS用dT和dP表示),则:
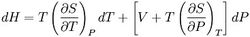
推导:由于:
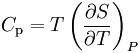
所以上式可以写成:
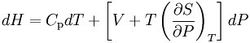
绝热膨胀热膨胀是指与外界没有热量交换,但气体对外界做功,气体膨胀。根据热力学第一定律,可证明这是等熵过程,在这个过程中气体体积增大,压强降低,因而温度降低。所以绝热膨胀经常用于降低气体的温度,起到冷冻的效应。
绝热膨胀过程中,气体的体积V增大,压强p降低,等熵过程的温度随压强的变化而变化。过程可用等熵效应系数来衡量。又由于系统不和外界交换热量,即dQ=0,故由热力学第一定律,气体的温度必然降低。
从能量转化的角度看,气体在绝热膨胀过程中减少其内能而对外做功,膨胀后气体分子间的平均距离增大,吸力的影响减弱而使分子间的互作用能量有所增加。内能既减少,相互作用能量又增加,分子的平均动能必减少,因而气体的温度下降,起到冷冻的效果。
绝热膨胀法是德国科学家林德等人在征服“永久气体”的过程中研究发现的。压缩—绝热膨胀法的过程是先向容器里装入气体,施加高压,通过外界做功,使气体体积变小,气体分子运动加快(增加分子的平均动能),温度升高,接着通过冷却剂的蒸发吸热,带走热量,把受压气体冷却到原来的温度。然后断绝容器(系统)与外界的热交换,让受压的气体通过狭窄的口子急剧膨胀,对外做功,由于从外界吸收的热量为零,因此只能减少自身的内能,从而达到降温的目的。
绝热过程热力学系统始终不与外界交换热量, 即dQ =0 的过程。理想气体准静态绝热过程的方程为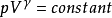 ,其中p、V 是理想气体的压强、体积,
,其中p、V 是理想气体的压强、体积,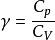 是定压热容与定体热容之比。根据热力学第一定律,在绝热过程中,系统对外所作的功等于内能的减少量。根据热力学第二定律,在可逆的绝热过程中,系统的熵不变。用良好绝热材料隔绝的系统中进行的过程,或由于过程进行得太快,来不及与外界有显著热量交换的过程,都可近似地看作绝热过程。例如内燃机、蒸汽机汽缸中工作物质的膨胀过程, 压汽机汽缸中的压缩过程,汽轮机喷管中的膨胀过程,以及气象学中空气团的升降过程,还有声波在空气中的传播过程等,都可当作绝热过程处理。
是定压热容与定体热容之比。根据热力学第一定律,在绝热过程中,系统对外所作的功等于内能的减少量。根据热力学第二定律,在可逆的绝热过程中,系统的熵不变。用良好绝热材料隔绝的系统中进行的过程,或由于过程进行得太快,来不及与外界有显著热量交换的过程,都可近似地看作绝热过程。例如内燃机、蒸汽机汽缸中工作物质的膨胀过程, 压汽机汽缸中的压缩过程,汽轮机喷管中的膨胀过程,以及气象学中空气团的升降过程,还有声波在空气中的传播过程等,都可当作绝热过程处理。
在和周围环境之间没有热量交换或者没有质量交换的情况下,一个系统的状态的变化。大气层中的许多重要现象都和绝热变化有关。例如,在大气层的下层通常存在着温度随高度而递减,主要就是由于空气绝热混合的结果。导致水蒸汽凝结、云和雨形成的降温作用,主要是由于空气上升时温度下降的结果;晴朗的、干燥的天气通常是与空气下沉引起的增温变干作用有关。上升空气的降温作用和下沉空气的增温作用主要是由于空气的绝热膨胀和绝热压缩的结果。如果一个受到增温作用或降温作用的系统通过辐射和传导与周围发生热量交换,那么就称之为非绝热过程(diabaticprocess)。3




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国