简介
大豆中含有一种毒性物质,叫做胰蛋白酶阻碍因子(TI)。是在1944年发现的,一年后康尼兹( Kuntiz)成功地制成结晶。其性质概括如下:等电点为4.5,与球蛋白相似,相对分子质量21500,氨基酸残基数为194,N末端是天冬氨酸,C末端是亮氨酸,含有两个胱氨酸基而不含半胱氨酸基的链状蛋白质。但根据最近的研究证明,胰蛋白酶阻碍因子并非单一的蛋白质,而是各种蛋白质的混合物,其数目为4-7个,其中之一显示出和康尼兹所制取的,TI有同样的性质。
阻碍机制作用由于康尼兹(Kunitz)提取了胰蛋白酶和TI混合物的结晶体,从而明确了它的阻碍作用的机制,它具有抑制小肠中胰蛋白酶活力的作用,因而食用后会妨碍食物中蛋白质的消化、吸收和利用,其毒性是可引起胰肠肥大。在湿热条件下加热时,胰蛋白酶阻碍因子容易被破坏。所以在食品加工的实际问题上,它的毒性并不重要。但另一种观点认为大豆胰蛋白酶抑制素的热稳定性是大豆加工中最为关注的问题之一。胰蛋白酶抑制素的热稳定性比较高。在80℃时,其残存活性仍在80%以上,而且增加热处理时间并不能显著降低其活性。因此要降低胰蛋白酶抑制素的活性需要继续升高温度,胰蛋白酶抑制素活性与加热温度、加热时间的关系见图1。从图中可见,当加热温度为100℃,加热时间为10min时,胰蛋白酶抑制素的活性单位为13,当加热温度为120℃,加热时间为10min时,胰蛋白酶抑制素的活力单位只有3;从图中还可以看出随着加热温度的升高,加热时间的延长,胰蛋白酶抑制素的活性单位逐渐变小,因此工业生产中可以根据不同需求而确定适宜的加热温度和加热时间,使胰蛋白酶抑制素的活性降至生产所需达到的水平1。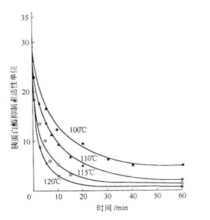
TI在动物体内的作用动物体内的胰蛋白酶和胰凝乳蛋白酶是分解食物蛋白质的专一蛋白酶。由于TI能分别与上述两种蛋白酶活性中心专一性结合,使它们失去了分解蛋白质的能力,由此引起蛋白质消化率下降、营养效价降低。并导致消化不良、食欲下降、乃至生长停滞等不良反应。但另有研究报道,在动物饲料中加入预先消化过的蛋白质或混合氨基酸制品后,TI仍能抑制动物的生长。因此认为,TI抑制胰腺中蛋白酶的活性不是导致动物生长停滞的惟一原因。进一步研究发现,TI本身就能引起动物胰腺增大,从而加速刺激了胰腺分泌活性增加,促使胰腺机能产生亢进,导致胰脏过度分泌蛋白水解酶,结果造成了动物机体内必需氨基酸的内源性损失,进而也就降低了蛋白质本来的营养效价。另外,由于胰蛋白酶和胰凝乳蛋白酶均富含硫氨基酸,而当胰腺肿大时,势必要消耗更多的含硫氨基酸来合成补充胰脏中损失的蛋白酶,从而造成机体组织内严重缺乏含硫氨基酸。又因大豆蛋白质本来就缺少含硫氨基酸,如此,则使必需氨基酸的自行损耗较多,且又不能及时得到补给,结果使氨基酸的比例失调,很难维持动物体内的营养需求,必然也就会导致动物的生长停滞。
胰腺的分泌是由其反馈抑制所调解控制的,而且此种抑制主要取决于小肠内胰蛋白酶和胰凝乳蛋白酶的含量。当这两种酶的量达到正常水平时,就会反馈抑制胰腺中蛋白酶的合成。反之,当这两种酶的含量下降到临界值以下时,就会反射刺激胰腺来合成更多的酶。同时还认为,胰腺内蛋白酶的合成也可能是由激素性质的肠促胰酶肽所调控。由此可以推论,TI引起甲状腺肿大的机制可能在于TI与胰蛋白酶结合形成复合物后,蛋白酶的含量明显降低,此时负反馈抑制失去作用,而肠促胰酶肽的活性增强,促使胰腺合成蛋白酶,此过程称之为负反馈抑制作用的抑制,结果使胰腺机能亢进而产生肿大。
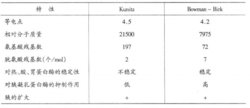
一般认为大豆中至少存在5种胰蛋白酶抑制剂,但至今只有两种被分离纯化出来,并得到较详细的研究。1947年和1961年,Kunitz与Bowman - Birk分别提纯了两种胰蛋白酶抑制剂,它们在豆中的含量分别为1.4%和0.6%。后来人们用他们的姓氏分别命名了这两种胰蛋白酶抑制剂,其性能见图2。
上述两种抑制剂的等电点都处在偏酸性范围,Bowlnan - Birk抑制剂对热、酸、胃蛋白酶的稳定性及对胰凝乳蛋白酶的抑制作用均高于Kunitz抑制剂,这是因为前者每摩尔具有7个脱氨酸残基,而后者只有2个。胱氨酸残基的二硫化物能有效地稳定大分子结构。胰蛋白酶抑制剂的毒性是可引起胰脏肥大2。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国