热力学的研究对象及其限度
热力学是研究能量相互转换过程中所遵循的规律的科学。因为能量转变是普遍存在的,所以热力学研究的范围及其应用是很广泛的,主要有以下三个方面:
(1) 物理学上的应用,叫物理热力学。
(2) 在热机方面的应用,如蒸汽机、内燃机等,叫工程热力学。
(3) 在化学现象以及和化学有关的物理现象上的应用,就构成“化学热力学”这一门学科。2
化学热力学是本书所讨论的主要内容,它具体解决两大问题:一是研究物质进行某一过程时,在不同条件下能量的转化问题。化工生产总是与热交换、压缩或膨胀、冷疑、蒸发,以及化学反应等过程分不开的。在这些过程中,无一不伴随着能量的转化和传递。例如在合成氨厂中,用电加热器升高合成塔内触媒的温度,就是把电能通过电加热器转化成了热量而增加触媒的内能。合成反应进行时所放出的热量就是由化学能转化而来6乙又如在使用煤气时,我们希望知道一定量的煤气究竟能发生多少热量?这方面的问题都可应用热力学第一定律来解决,并用它来计算化学变化中的热效应。二是研究在一定条件下,化学反应进行的方向和限度,这可由热力学第二定律来解决。例如为了试制某产品或对旧的合成路线进行改进,首先要知道所设想的路线是否可能进行,这就是反应进行的方向。如果能进行,那么,在一定条件下(温度、压力、浓度等),这一反应能进行到什么程度为止,其最大产量是多少,这就是化学反应的限度(指反应达到平衡或最大产量)。2
热力学研究的主要依据是热力举第一定律和热力学第二定律。这两个定律是人们对含有极大量质点的宏观物质的运动过程,进行了长期的探讨、实践总结出末的。它的正确性是由无数次的实验事实所证实,而不能从逻辑上或其他理论方法来加以证明。至于本世纪初所发现的热力学第三定律,其基础就远没有第一定律和第二定律广泛了,但是对于化学平衡的计算,却具有重大的意义。2
虽然热力学的应用是如此广泛和重要,但我们应当看到,它并不是万能的,热力学本身还存在着一定的局限性:
(1) 热力学研究的是宏观体系的性质间的关系,所以热力学只能阐明由大量微粒组成的体系所表现出来的整体行为,而不能说明宏观体系中个别粒子的单独行为。也就是说热力学无法解答物质的结构、反应的机理等涉及微观质点的问题。
(2) 热力学只能指出在一定条件下化学反应向某方向进行的可能性,以及进行到什么程度为止,至于过程在什么时候发生,到什么时候停止,热力学无法预测,因为热力学所研究的变量中,没有时间的概念,所以它不涉及过程进行的速度问题。
(3) 热力学只能计算出反应达到平衡时的最大产量,而不能告诉我们在某有限时间内的实际产量。
尽管热力学有上述这些局限性,但它仍然是一种有用的理论工具。由于热力学的两条定律是人类反复实践的经验总结,根据热力学所得出的结论具有高度的可靠性,因而对生产实践和科学研究都具有重要的指导意义。3
热力学的三原理结构热力学的整个结构由以下三部分组成:
1.能的概念和热力学第一定律。
2.熵的概念和热力学第二定律。
3.状态公设和物质的特性关系式。2
为了着重说明结构的简单性,这里我们想引用了一个当代著名的热力学专家小组所作的关于热力学教学的报告。报告的结束语中说:
在热力学中尽管有数百个数学关系式这样一个庞大结构,但它们都是建立在三个基本方程式,即能量方程、熵方程和特性方程基础之上的,这是我们所需要强调的。2
能的概念,熵的概念和状态公设之间互相都有联系。这可以由温度的定义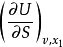 和压力
和压力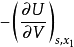 的定义中看得出来。相互联系的中心问题是平衡的概念,平衡常常被认为是理所当然的概念。事实上,经典热力学的正确性,其关键在于平衡的存在,而热力学的实用性则取决于我们确定平衡状态的能力。图8-1刻画出了热力学的简明结构。热力学的结构可以看作是“三个圈的杂技场",如同现实生活中的杂技表演场一样,专业表演者既能给自己带来极大的愉快,又能造福于别人。2
的定义中看得出来。相互联系的中心问题是平衡的概念,平衡常常被认为是理所当然的概念。事实上,经典热力学的正确性,其关键在于平衡的存在,而热力学的实用性则取决于我们确定平衡状态的能力。图8-1刻画出了热力学的简明结构。热力学的结构可以看作是“三个圈的杂技场",如同现实生活中的杂技表演场一样,专业表演者既能给自己带来极大的愉快,又能造福于别人。2
热力学第一定律的描述能量不能无中生有,亦不能无形消灭,这一原理早就为人们所知。第一个提出能量守恒和转化定律的科学家是迈耶尔(J.R.Maye,1814—1878),而此定律得到物理学家的确认,是在焦耳(J。P,Joule 1818—1889)的实验工作发展之后。焦耳先后用各种不同的方法做过机械能转化为热能的精确实验,他进行这一类实验前后有二十多年,所得到的结果都是一致的。也就是说热与功间转化具有一定的当量关系,这就是著名的热功当量: 1卡=4.184焦耳。它为能量守恒原理提供了科学的实验证明。3
热力学第一定律
对宏观体系而言,能量守恒原理就是热力学第一定律。换句话说,热力学第一定律就是能量守恒与转化定律在热现象领域内所具有的特殊形式。通常表达为“自然界的一切物质都具有能量,能量有各种不同的形式,能够从一种形式转化为另一种形式,在转化中能量的总数量不变”,换言之,即“在孤立体系中,能的形式可以转化,但能量的总值不变”。这一定律直接证明了物质运动既不能创造,也不能消灭,而,运动形式的转化是物质本身所具有的属性。恩格斯对能量守恒和转化定律曾给予很高的评价,并且将它和细胞学说及进化论相提并论,称它们是揭示自然界辩证发展过程的自然科学的三大发现。3
这一定律是根据无数次事实及实验总结出来的,而不是根据什么原理推导出来的。迄今为止没有发现任何自然界的变化违反这个定律,这也就最手‘力地证明了这个定律的正确性。根据这一定律,做功必须消耗一定的能量,因此有人曾经企图以消耗较少的能量使机器做较多的功,或者设想在不消耗任何能崁的悄况下使机器做功的假想机器(称为第一类永动机)是不可能造成的。基于这一点,“第一类永动机是不可能造成的”,这也可作为热力学第一定律的另一种表达方式。热力学第一定律的说法有很多,但都是说明同一个问题——能量守恒。3
内能
辩证唯物主义告诉我们,运动是物质的本质属性。绝对静止的,没有运动的物质是不可思议的,而能量就是衡量物质运动程度的物理尺度。由于运动是物质的本质属性,所以能量也是物质的本质属性,即一切物质都具有能量。任何一个体系的能量一般可以分为三部分:
(1) 整个体系在空间移动所产生的动能。
(2) 整个体系处于外力场中所产生的势能。例如在重力场中的位能,带电物质在电场中的势能等。
(3) 体系内部的能·量,称为内能。用符号U来表示,它包括这样几部分;①分子运动的动能,②分子之间互相作用的势能,③分子中原子和电子互相作用和运动的能量,如原子振动能,化学键能等,④原子核内的能量。所有这些能量的总和就称为内能。3
在化学热力学中,通常是研究宏观静止的体系,无整体运动,并且一般没有特殊的外力场存在(如电磁场,离心力场等)。因此只注意内能,也就是说不考虑体系在外力场中作整体运动时的能量。下面举一个简单的例子加以说明。一个在空中快速运动的乒乓球,既有动能又有重力位能,如果乒乓球静JE放在地面上,那末乒乓球相对于地面既没有动能,也没有位能(因假定体系在地面上的位能等于零)。但一切物质都是运动的,这一普遍规律对在地面上的乒乓球照样适用,也就是说乒乓球的外壳及球内的气体,它们的分子每时每刻都在作无规则的运动,因此每个分子都有动能,但由于运动的无规则性,分子运动的速度不同,因而每个分子的动能也不同,但总的分子平均动能在一定状态下是一定的。除此以外,分子间还有相互作用力,因此构成物体的分子间还有位能,此位能大小决定于分子间的相对位置。3
由上分析可知,体系的内能不包括体系整体运动的动能和体系整体处于外力场中具有的位能。一定量某种物质的内能是由物质种类、温度、体积等性质所决定的,所以内能也是体系的一种性质,或者说是状态函数。下式表达了一定量某种物质的内能为T和V的函数,即
U=f(T,V)体系状态发生变化时,只要没有化学反应发生,即物质种类不变,则由上式可知内能的变化是由体系的温度、体积变化所确定。3
若体系是理想气体,理想气体分子间无相互作用力,故体系的内位能为零。一定量某种理想气体的内能应当只由气体的温度来确定,即U=f(T)。3
由于内能包括位能等因素,所以它的绝对值是很难知道的?但是这一点对于实际问题的解决并无妨碍,因为在实际问题中,考虑的主要是内能的变化值。当体系的内能发生变化时,内能的差值可以由过程中体系和环境能量传遍的热和功的数值来碑定。内能既是体系内部能量的总和,它就;乏体系本身的性质,所以只取决于状态,在一定状态下应有——定的内能数值。3
根据热力学第一定律也可证明内能是状态函数。设体系从始态A经I和Ⅱ两条不同的途径到达终态B,如图1—5所示。如果内能不是状态函数,则沿途径I变化的内能增量△U1和沿途:
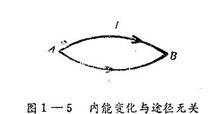
径Ⅱ变化的内能增量△U2不相等,即△U1≠△U2。设△U1>△U2,今自止出发,沿途径I到B,然后又沿途径Ⅱ逆向到A,这样循环一周,体系又恢复原来状态。由A沿途径I到B,内能变化为△U1,而由B沿途径Ⅱ逆向回到A,内能变化方—△U2,所以循环一周总能量变化为
△U=△U1+(一△U2)=(△U1—△U2)>0
这说明体系循环一周,恢复原来状态,凭空有了剩余的能量,如此反复不断地循环进行,就成为第一类永动机,这显然是违反热力学第一定律的。因此△U1≠△U2是不能成立的,只能是△U1=△U2,即内能的改变与过程无关而仅决定于始态和终态,所以内能U是体系的状态函数。这是内能的一个很重要的性质。3
热力学第一定律的数学表达式
上面已经用文字阐述丁热力学第一定律,明确了体系内能钓重要性质,以及任何封闭体系的内能变化都是由于体系与环境之间孔负1与功传递的结果。怎样用第一定律来解决问题呢?必须有能够代表热力学第一公律的公式才行,否则单用热力学第—定律的几种说法是不能解决定量问题的。3
为了引出热力学第一定律的数学表达式,让我们考察一个简单的:体系。如图1—6所示,气缸中有水,水面上有水蒸气,当不加热时,活塞来动,如双虚线所示,此时体系内能为U1。当加热气缸时,水从环境吸收了热量q以后,水温度升高,内能增加△U,同时水蒸发,蒸气压加大,推动活塞,对环境作了功W。根据能量守恒原理,所吸收的热量q一部分使水温升高,增加内能△U:一部分又对外作了功。3
q=△U+W
△U=U2-U1=q-W ( 1—5)3
对于一个封闭体系来说,式(1-5)就是热力学第一‘定律的数学表达式,它表示了内能改变是体系与环境能量传递的两种基本形式——功与热之间的最基本的关系式。其物理意义是体系所吸收热量q减去体系对环境所作的功W等于体系内能的增量△U。
根据热力学第一定律得知,封闭体系在变化过程中听增加的能量必然来自环境,也就是说,环境的能量变化必然与△U体系的数值相等,而符号相反。3
△U体系+△U环环=0
当体系发生一个无限小变化时,由于U是体系的状态函数,所以用全微分“d”的符号,把体系内能的相应无限小变化写成dU。功和热也相应地有一个微小量的变化,由于热q和W不是状态函数,所以用变分符号“δ”表示,这样式(1—5)可写成
dU=δq-δW (1-6)3
热力学第二定律的描述既然能被定义为作功的能力,那么能的品质就有理由用可能的作功能力来表示,因而我们可以这样说。如果系统A中的单位能量可能作的功多于系统B中单位能量可能作的功,那么系统A中单位能量的品质就高于系统B中单位能量的品质。这也意味着功源中能量的品质最高。系统中可能作功的那部分能含称作系统的可用功或可用能。系统的可用功可以根据系统与标准源相互作用,准静态地进行状态变化的原则来确定.如果把系统的可用功记作E可用,系统的总能含记作E,则
E=E可用+E不可用,
式中E不可用可以称作系统的不可用能。2
一个闭口系统经历状态变化的时候,一般地说,系统既会有总能含的变化,也会有可用功的变化。我们将按照哈特索普劳斯和基南‘1 3的说法来定义一个基本的特性参数——熵S,即系统在状态变化过程中,熵的变化dS与能的变化dE以及相对于某一标准源所计算的可用功的变化dE可用有如下的关系:
dS=C(dE-dE可用)
式中C为任意正值常数,其数值取决于标准源。熵的这一定义意味着它与系统的不可用能成比例,并且它是一个量性参数。2
对于孤立系统,按照热力学第一定律,dE=0,同时按照能的降级原理,dE可用必然是负值。所以,对于孤立系统,由式2—1必然有
(dS)孤立≥0. (2-2)
式2—2是热力学第二定律的数学表达式。它说明孤立系统的熵永远不可能减小。尽管对热力学第二定律曾经有过许多的说法,但是所有的陈述可以说都是类似的。而且所有各种陈述最后都得出了和式4-2所概括的同样的结论。2
因为系统连同它的外界在任何已知的相互作用下均构成了一个孤立系统,所以我们还可以把热力学第二定律表示为:
(dS)系统+(dS)外界≥0. (2-3)
回忆可逆过程和不可逆过程的区别,对于前者不论什么过程均不存在能量耗散效果,但是对后者却总有能量耗散效果。因此,式2—2和式2—3中的不等号适用于孤立系统中进行的各种不可逆过程的情况’等号适用于孤立系统中所进行的过程都是可逆过程的情况。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国