简介
煤作为我国动力生产的主要原料,在工业生产和日常生活中使用十分广泛,而且蕴藏蔓十分丰富.所以进行强化煤的燃烧研究,探讨以煤代油的途径,对节约能源,降低燃烧成本,具有十分重要的意义2.
近年来,研究者使用了众多的催化燃烧的方法,但是从化学动力学角度出发,1988年,曾经有人使用碳酸钾,碳酸钠和碳酸钙对煤的点火性能进行了研究。在研究过程中,他们使用了工业煤试样,点火装置采用。碳酸盐对煤的燃烧有较明显的催化作用.用工业煤粉作为实验试样,存在以下缺点:燃烧时间短,燃烧后表明有坚硬的灰壳,不易观察燃烧过程,在大多数情况下,燃烧不够完全,而且燃烧后产生的固体灰分也能对燃烧过程起催化作用。
.
炭粒的着火着火:燃料由缓慢氧化状态转变到高速燃烧状态的瞬间过程称为着火3。
改善着火的措施:
加强放热:增加可燃混合物的浓度、压力以及可燃混合物的初温
减小散热:减小气流速度,增加混合物初温
煤粉气流的着火
着火热来源:卷吸周围高温烟气并接受高温火焰的辐射
着火热:包括加热煤粉及一次风,并使煤粉中水分加热、蒸发、过热所需热量
影响着火热的因素:
1.燃料性质(挥发分、水分、灰分、煤粉细度)
2.一次风温、一次风速、一次风量
3.炉内散热条件
4.燃烧器结构特性
5.锅炉负荷
稳定着火过程的常用方法:
(1)组织强烈的煤粉气流与高温烟气的混合
(2)提高一次风温、采用合适的一次风量和风速
(3)采用较细的煤粉和敷设卫燃带
煤粉燃烧的三个阶段(1)着火前的准备阶段
煤粉气流喷入炉内至着火这一阶段为着火前的准备阶段。着火前的准备阶段是吸热阶段。在此阶段内,煤粉气流被烟气不断加热,温度逐渐升高。煤粉受热后,首先是水分蒸发,接着干燥的煤粉进行热分解并析出挥发分。一般认为,从煤粉中析出的挥发分先着火燃烧。挥发分燃烧放出的热量又加热炭粒,炭粒温度迅速升高,当炭粒加热至一定温度并有氧补充到炭粒表面时,炭粒着火燃烧。
(2)燃烧阶段
煤粉着火后进入燃烧阶段。燃烧阶段是一个强放热阶段。煤粉颗粒的着火燃烧首先从局部开始,然后迅速扩展到整个表面。煤粉气流一旦着火燃烧,可燃质与氧发生高速的燃烧化学反应、放出大量的热量,放热量大于周围水冷壁的吸热量,烟气温度迅速升高达到最大值,氧浓度及飞灰含碳量则急剧下降。
(3)燃尽阶段
燃尽阶段是燃烧过程的继续。煤粉经过燃烧后,炭粒变小,表面形成灰壳,大部分可燃物已经燃尽,只剩少量未燃尽继续燃烧。在燃尽阶段中,氧浓度相应减少,气流的扰动减弱,燃烧速度明显下降,燃烧放热量小于水冷壁吸热量,烟温逐渐降低,因此燃尽阶段占整个燃烧阶段的时间最长。
炭粒的燃烧机理炭粒表面燃烧过程:
温度低于1200℃

温度高于1200℃

燃烧:当燃料与氧化剂属于同一形态,称为均相燃烧或单相燃烧;当燃料与氧化剂不属于同一形态,称为多相燃烧,例如固体燃料在空气中的燃烧。
煤粉燃烧的关键是其中炭粒的燃烧。这是因为:
焦炭中的碳是大多数固体燃料可燃质的主要成分;
焦炭的燃烧过程是整个燃烧过程中最长的阶段,在很大程度上它能决定整个粒子的燃烧时间;
焦炭中碳燃烧的放热量占煤发热量的40%(泥煤)~95%(无烟煤)它的发展对其他阶段的进行有着决定性的影响。因此,煤粉的整个燃烧过程中,关键在于组织好焦炭中炭的燃烧。
碳粒的燃烧机理是比较复杂的。大多数研究认为,碳与氧作用同时生成CO2和CO,其反应式为:
C+O2→CO2
2C+O2 →2CO
上述反应式称为一次反应,其反应生成的CO2和CO还伴随有下述反应,即:
CO2+C →2CO
2CO+O2 →2CO2
上述反应式称为二次反应,反应中生成的CO和CO2称为二次产物。
碳粒在静止的空气中燃烧:
碳粒在静止的空气中或碳粒与空气两者无相对运动燃烧时,在不同温度下,上述这些反应以不同方式组合成碳粒的燃烧过程。
当温度低于1200℃时,按下示反应式进行燃烧反应4:
4C+3O2 → 2CO+2CO2
此时由于温度较低,在碳粒表面生成的C02不能与C发生上式所示气化反应。
当温度高于1200℃以后,碳粒燃烧开始转向如下反应:
3C+2O2 →2CO+CO2
此时,由于温度升高加速了碳粒表面的反应,生成更多的CO。同时气化反应也因温度升高而显著地进行。CO在向外扩散途中遇到远处向碳粒表面扩散的氧而产生燃烧,并将氧全部消耗掉。反应生成的C02同时向碳粒表面和周围环境两方扩散。
燃烧速度和燃烧区域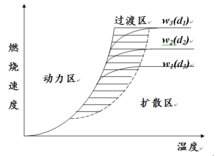 (1)氧气从周围环境扩散到炭粒的表面5
(1)氧气从周围环境扩散到炭粒的表面5
(2)氧气被炭粒表面吸附
(3)在炭粒表面进行的燃烧化学反应
(4)燃烧产物由炭粒解吸附
(5)燃烧产物离开炭粒表面,扩散到周围环境中
CO火焰对碳粒燃烧影响碳颗粒在氧化性气氛中的燃烧是包括多种表面反应及气相反应的复杂系统.现代燃烧理论的连续膜模型已从理论上阐明了碳粒表面氧化反应一次产物CO与O2的空间反应对碳粒表面温度及其总体反应速率的影响是极其复杂的[’〕.然而,由于高度非线性的气相燃烧与碳粒表面反应热质祸合理论处理的复杂性,及捕捉持续时间极短的颗粒表面CO火焰的实验测量的困难性,在煤粉燃烧的反应动力学实验研究及煤粉火焰数学模型的研究领域内,目前人们普遍采用的仍是假定CO在颗粒边界层中不燃烧的单膜模型.理论计算表明,CO能否在颗粒表面附近被点燃及其所引起的颗粒表面温度差可高达数百度.这一颗粒表面温度计算的不确定性,对煤粉的燃尽、燃料N的释放以及NO二生成和控制过程的数值模拟的影响是巨大的.正因为如此,这一课题至今仍是煤燃烧理论工作者们关注的热点之一4.
CO的空间反应与碳粒表面反应的相互作用及其对碳粒表面温度、总体反应速率的影响是极其复杂的.而CO能否在颗粒表面附近被点燃及其所引起的颗粒表面温度差可高达数百度.
在实际煤粉火焰条件下,单膜模型和严格的连续膜模型的预报结果相差比较大,特别是对着火点及着火后某段区间内的颗粒温度的预报,是仅考虑表面氧化反应C+1/2O2 →CO的单膜模型所无法完成的,这说明了单膜模型存在较大的应用局限性。
碳酸钠对碳粒燃烧的影响碳酸钠对燃烧过程的强化主要是通过降低碳氧反应的活化能来实现的.碳原子的活化能与石墨的晶格结构有很大关系,晶格表面和边缘处的碳原子活性最大.碳酸钠对燃烧的催化,由其化学性质可知,主要发生在700--1300℃.由于Na2CO3的暂时介入6使石墨晶格扭曲,碳原子活性增加,使C3O4更容易脱离晶格分解为CO和CO2,同时加速了C3O4的形成与分解。在温度高于950℃时,部分Na2CO3分解为Na20和 CO2,该反应使石墨晶格扭曲程度加剧,碳原子活性进一步提高,CO:和C3O4的撞击使C3O4分解加速.相对来说Na2O3分解生成的CO:在空气中扩散,对C30。离解平衡的影响不大.在温度大于1275℃时,Na2O升华,催化作用失去,碳粒由于结构变得相对疏松,燃烧继续加剧,直至烧尽.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国