水的分类
水的硬度是指水中钙、镁离子的浓度,水分为软水、硬水,凡不含或含有少量钙、镁离子少的水称为软水,反之称为硬水。水的硬度成份,如果是由碳酸氢钠或碳酸氢镁引起的,属于暂时性硬水(煮沸暂时性硬水,分解的碳酸氢钠,生成的不溶性碳酸盐而沉淀,水由硬水变成软水);如果是由含有钙、镁的硫酸盐或氯化物引起的,属于永久性硬水)通过烧煮不能将其除去。在天然水中,远离城市未受污染的雨水、雪水属于软水;泉水、溪水、江河水、水库水,多属于暂时性硬水,部分地下水属于高硬度水。目前,随着科学技术的迅猛发展,极大地推动了当代工业高速发展,渐渐改善人类生活条件的同时,水资源也遭受着严重的污染,水中钙、镁等有害离子的严重超标,不仅危害着人体健康,而且危害着工业生产及涉水性日常生活。
水硬度测定在一份水样中加入pH=10.0的氨性缓冲溶液和少许铬黑T指示剂,铬黑 T首先与金属镁离子配位生成MgIn离子,溶液呈红色;用EDTA标准溶液滴定时,EDTA先与游离的钙离子配位,再与镁离子配位;在计量点时,EDTA从 MgIn离子中夺取镁离子,从而使指示剂游离出来,溶液的颜色由红变为纯蓝,即为终点。
当水样中镁离子极少时,由于CaIn离子比MgIn离子的显色灵敏度要差很多,往往得不到敏锐的终点。为了提高终点变色的敏锐性,可在EDTA标准溶液中加入适量的镁离子(在EDTA标定前加入,这样就不影响EDTA与被测离子之间的滴定定量关系),或在缓冲溶液中加入一定量的 Mg-EDTA盐。
水的总硬度可由EDTA标准溶液的浓度CEDTA和消耗体积V(ml)来计算。
以CaCO3(mg/L)表示:

水质标准中国建设部生活饮用水水源水质标准Ⅰ类≤350 Ⅱ类优质水≤450
中国生活饮用水国家标准≤450
中国建设部饮用净水水质标准≤300
中国建设部生活杂用水标准≤450
硬水的危害水的总硬度不能过大,如果硬度过大,饮用后对人体健康与日常生活有一定影响。在生活上,水的硬度过高,用来洗涤可使肥皂不起泡沫而造成浪费;用硬水洗衣物易使纺织物纤维变硬发脆而损坏;用硬水洗澡!洗头时有发涩发黏的感觉;用硬水烧豆与肉类不易熟烂;用硬水烧开水易使水壶结垢,浪费燃料1/3以上。在人体健康上,饮用高硬水易使人患暂时性胃肠不适、腹胀、泻肚、排气多,甚至引起肾结石等疾病。不仅如此,水壶与暖水瓶使用一段时间后,其内壁就会结满一层白色的水碱,除大部分为碳酸钙、碳酸镁外,还含有多种有害的汞、镉、铅、砷等元素,如不经常及时清除,反复用来烧水、装水后,有害元素积累越来越多,并能再次溶于水中,当人们饮用后就进入人体,从而引起人体慢性中毒甚至可致癌和致畸,严重危害人体健康。
高硬度水中钙镁离子与硫酸根结合,会使水产生苦涩味,还会使人的胃肠功能紊乱,出现暂时性腹胀、排气多、腹泻等现象。我国北方地区饮用硬度高的地下水,所以久居南方的人初到北方的开始一段时间会出现所谓“水土不服“的现象。
硬水软化方法化学沉降法对于永久硬水,由于钙离子、镁离子以硫酸盐式氯化物的形式存在,煮沸法不能使之软化,要用石灰乳和纯碱来除去。
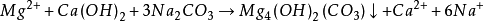
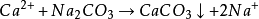
也可用Na3PO4或Na2HPO4作沉淀剂,使之与钙离子、镁离子反应生成Ca3(PO)2、Mg3(PO)2,不必过滤,因为沉淀疏松而且稳定,不会生成锅垢,所以带磷酸盐沉淀的水即可送入锅炉使用。
离子交换法目前,许多新型的合成离子交换剂可以用来交换水中的钙离子、镁离子等,使水软化,满足工业的要求。人造沸石就是其中之一,人造沸石的主要成分是 N2O·Al2O3·SiO2·nH2O,可以简写为Na2Z。当硬水通过沸石颗粒时,其中的Na+能被水中的钙离子、镁离子取代:
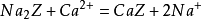
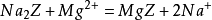
结果钙离子、镁离子留在交换剂上,而钠离子则进入溶液,达到软化水的目的。
待交换剂失去软化能力,可将其放置在8%-10%的食盐水中浸泡以恢复软化能力。在日常生活中:如洗面时,可在水中加半杯牛奶或一撮食盐,在一定程度上也除去钙、镁离子。
加热法将水煮沸,并多煮一会儿,可将钙镁离子转化为锅垢除掉,暂时性硬水在一定程度上得到软化。
经验法日常生活,我们也有简单办法除垢,保温瓶中倒入4%-5%盐酸可将瓶内水垢除去。用鸡蛋壳捏碎放入保温瓶中摇晃也可除去。1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国