1. 引言
细胞周期是一个受严密调控的有序发生的事件,基因组DNA完成复制,随后基因组均等地分裂成两个相似的细胞。细胞分裂周期最初被分为两期,有丝分裂期和分裂间期。1953年随着Watson and Crick详细地描述了DNA双螺旋结构模型,几乎在同时Howard and Pelc 最终把细胞周期分为四期:G1,S,G2和M期。
细胞是否能顺利完成增殖过程与细胞能否顺利地从细胞周期的上一阶段进入下一阶段密切相关,这些过程受到极其精准的调控。真核细胞能够使细胞周期事件正确地开启和结束,依赖于细胞内一个复杂的调控系统,即细胞周期调控系统。
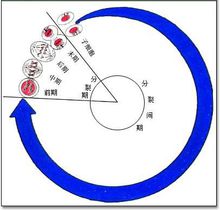
图1 细胞周期分期
- 细胞周期各期的特点G0期是静止期,不包括在细胞周期之中。通常认为在正常条件下,肾小管上皮细胞处于G0期,也有数据表明大鼠肾小管上皮细胞处于G1期。
G1期的特点是细胞体积增长以及合成DNA复制所需要的mRNA和蛋白质。
S期是DNA复制期。
G2期是细胞快速增长期以及有丝分裂期之前的蛋白质合成期。
M期是细胞生长停止以及有序的进行有丝分裂期。
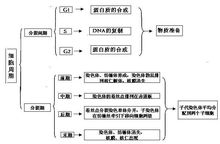
图2 细胞周期各期的特点
- 细胞周期进展的调控(1) 细胞周期检查点为了确保细胞周期有序进展,有许多被称为细胞周期检查点蛋白的质量控制点。细胞周期检查点是细胞增殖调控的关键位点。这些检测点蛋白能及时修复问题以保证细胞周期安全有序进行。目前,依据细胞周期的顺序循环分为:G1-S期检查点,S期检查点,G2期检查点和M期检查点。
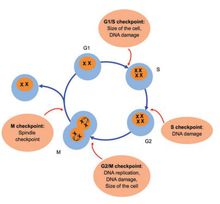
图3 细胞周期检查点
G1-S期检查点决定细胞是否增殖。细胞在该检查点对各种复杂的细胞内外信号进行整合和传递,根据检查结果决定细胞是否进行分裂,发生凋亡或进入G0期。 S期检查点可阻止DNA受损的细胞进行DNA合成 。可以检测DNA是否发生损伤,损伤的DNA分子是否得到修复,从而避免DNA得以复制传代。 G2期检查点阻止受损细胞进入有丝分裂 ,可防止细胞携带着受损的DNA和未复制的DNA进入有丝分裂。M期检查点又称纺锤体检查点,可阻止受损细胞进行分裂 ,监测姐妹染色单体是否已稳定地附着在纺锤体上,若未通过检查,细胞被阻止继续进行分裂。
(2) 细胞周期检查点由多种调控蛋白控制细胞周期有序地进展是受到细胞周期蛋白及细胞周期蛋白依赖性激酶(CDK)有序的合成,激活,严格的划分及降解实现的。
1982年,Tim Hunt and Tom Evans首先报道了一种蛋白称为细胞周期蛋B(cyclin B)
随后研究发现,cyclin D在G1早期合成,当细胞离开G1期进入S期时降解。Cyclin E在G1晚期合成,在S期降解;cyclin A在S期合成,当细胞通过S期离开G2期降解。CyclinB在G2晚期合成,在M晚期降解。
细胞周期依赖性蛋白激酶(CDK)属于蛋白质丝氨酸/苏氨酸激酶家族,可以催化来自ATP的磷酸基团与底物的丝氨酸/苏氨酸残基共价结合。CDK单独存在时不表现激酶活性,只有与其调节亚基cyclin结合时才表现出激酶活性。CDK的表达水平比较恒定,但由于cyclin的表达水平变化巨大,CDK的激酶活性在细胞周期中呈现明显的震荡变化。
4 细胞期周阻滞与疾病细胞周期调控需要大量的胞内外信号的配合,如果缺乏适当的信号,细胞将不能从一个阶段进入下一个阶段,这种现象称为细胞周期阻滞。细胞周期阻滞有助于维持基因的稳定性,细胞周期调控的基因突变在肿瘤的发生中发挥重要作用。当细胞周期正常时,如果DNA出现损伤,细胞周期停在相应检查点,细胞周期阻滞为细胞提供额外的时间用于修复损伤,从而减少突变的发生,避免肿瘤的产生。
有研究表明,当发生急性肾损伤时,大多数肾小管发生可逆性损伤,可以得到修复,恢复小管功能;如果损伤因素持续存在,肾小管上皮细胞不能进行正常的修复过程,则发生G2/M期阻滞,阻滞的肾小管上皮细胞分泌大量的TGF-β,CTGF等纤维化因子以及持续激活成纤维细胞,导致成纤维细胞持续分泌胶原,Fibronecin等细胞外基质,导致肾脏纤维化的发生。
因此,对于细胞周期以及细胞周期调控的研究,对于一些与细胞周期有关疾病的预防和治疗有极其重要的意义。
参考资料:[1]. 王海燕, 张敏与邹萍, 细胞周期检测点激酶1的研究进展. 医学分子生物学杂志, 2005(02): 第147-149页.
[2]. Cell Cycle Events During Renal Injury.
[3]. STUART J. SHANKLAND Cell-cycle control and renal disease. Kidney International, Vol. 52 (1997), pp. 294 —308
[4]. Kellum, J.A. and L.S. Chawla, Cell-cycle arrest and acute kidney injury: the light and the dark sides. Nephrology Dialysis Transplantation, 2015. Jun 4. pii: gfv130
[5]. Price, P.M., R.L. Safirstein and J. Megyesi, The cell cycle and acute kidney injury. Kidney International, 2009. 76(6): p. 604-613.
[6]. Hayashi, M.T., et al., Cell death during crisis is mediated by mitotic telomere deprotection. Nature, 2015. 522(7557): p. 492-496.
[7]. Wynn, T.A., Fibrosis under arrest. Nat Med, 2010. 16(5): p. 523-5.
[8]. Bollen M ,et al,Cell cycle:It takes three to find the exit. Nature.2015 Jan 1;517(
7532):29-30. doi: 10.1038/nature14080
[9]. 朱虹, 缪泽鸿与丁健, ATM、ATR和DNA损伤介导的细胞周期阻滞. 生命科学, 2007(02): 第139-148页.
[10]. Yang, L., et al., Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury. Nature Medicine, 2010. 16(5): p. 535-543.
[11]. Lovisa, S., et al., Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis. Nature Medicine, 2015. 21(9): p. 998-1009.
[12]. Bechtel, W., et al., Methylation determines fibroblast activation and fibrogenesis in the kidney. Nature Medicine, 2010. 16(5): p. 544-550.
[13]Guillaume Canaud1 and Joseph V. Bonventre Cell cycle arrest and the evolution of chronic kidney disease from acute kidney injury Nephrol Dial Transplant (2014) 0: 1–9doi:10.1093/ndt/gfu230




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国