碳酸化的原理
水吸收二氧化碳的过程实际上是一个化学反应过程。
CO2+H2O→H2CO3
该反应服从亨利定律和道尔顿定律。
(1)亨利定律
气体溶解在液体中时,在一定的温度条件下,一定量液体中溶解气体量与液体保持平衡时的气体压力成正比,即:
V=H x p
式中:V——溶解气体的量;
H——亨利常数,与溶质、溶剂及温度有关;
P——平衡压力。
(2)道尔顿定律
混合气体的总压力等于各组成气体的分压力之和,即:
P=p1+p2+……pi
式中pi——各组分气体在温度不变时,单独占据混合气体所占的全部体积时对器壁施加的压力1。
二氧化碳在水中的溶解度在一定温度和压力下,二氧化碳在水中的最大溶解量即为二氧化碳在水中的溶解度。这时气体从液面逸出的速度和气体进入液体的速度达到平衡,即为达到饱和,该溶液称为饱和溶液。未达到最大溶解量的溶液叫不饱和溶液。
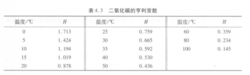
关于气体溶解度的表示方法,我国一般用溶于液体中的气体容积来表示,对于二氧化碳来说,在0.1 MPa、15.56℃时,1体积水可以溶解1体积的二氧化碳,也就是说0.1 MPa、15.56℃时,二氧化碳的溶解度近似为1。欧洲则用每升溶液中所溶解的二氧化碳的质量(g/L)作为溶解度的单位。在0.1 MPa不同温度下,二氧化碳的溶解度见图12。
影响碳酸化作用的影响碳酸化作用的几个主要因素有几下几个方面。
(1)二氧化碳的分压
当温度不变时,混合气体中二氧化碳的分压增高,二氧化碳在水中的溶解度就会增大。在0.5 MPa以下的压力时,二氧化碳的分压与其在水中的溶解度成线性正比关系。
(2)液体的温度
压力较低时,在压力不变的情况下,水温降低,二氧化碳在水中的溶解度会增加,反之,温度升高,溶解度减少。温度影响的常数称为亨利常数,以H表示。从图2中可以看出,H随温度变化而变化。这仅指的是压力较低时,压力较高时会有偏离,因为H还是压力的函数。
(3)气体和液体的接触面积与时间
溶解不足瞬间完成的,需要一定的时间,但时间太长将会影响设备的生产能力。一般采用增大接触面积的方法,如将溶液喷雾成液滴状或薄膜状3。
(4)气液体系中的空气含量(水中空气含量)
根据道尔顿定律和亨利定律,各种气体的溶解量不仅决定于各气体在液体中的溶解度,而且决定于气体在混合气体中的分压。在0.1 MPa、20℃时,1体积空气溶解于水中可以排走50倍体移的二氧化碳,因此要尽量排除气液体系中的空气。常用有如下两种方法。
①真空脱氧
迫使液体形成雾滴或液膜,并造成负压,借助于液体内部压力大于外部压力的压差,使溶解于液体中的空气逸出。
②二氧化碳脱氧
利用水中二氧化碳的溶解度大于空气的特点,将水或未碳酸化的饮料进行预碳酸化。该法要求二氧化碳气体的纯度极高,较少采用。
③液体的种类及存在于液体中的溶质
不同种类的液体以及液体中存住的不同溶质对二氧化碳溶解度影响很大,在标准状态下,二氧化碳在水中的溶解度是1.713,二氧化碳在洒精中的溶解度则为4.329。另外,当液体中溶解的胶体、盐类等类似的溶质时,有利于二氧化碳的溶解,而当液体中含有悬浮类杂质时,不利于二氧化碳的溶解。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国