简介
直接测定恒容过程热效应QV(ΔU)和恒压过程热效应QP(ΔH)的实验方法称为量热法。量热法是热力学实验中的一个基本方法。通常能直接测定的热效应,有物质的热容、溶解热、稀释热、中和热和燃烧热等,测定这些热效应,还可求算某些化合物的生成焓。物质变化过程中的热量值,在化工设计和生产实际中都有重要意义,热效应的数据常用于计算平衡常数和其他热力学量。热力学第一定律是量热测定的基础,热量测量的设计原理是:在绝热条件下,将被测物质置于某一量热体系中进行反应,它的热效应使体系的温度升高或降低,测量反应前后温度的变化△丁及体系的热容C,根据热力学第一定律即可计算反应的热效应。
量热法所研究的对象,是在具体过程中所发生的能量变化,它通常以热的形式存在。热是人们从远古以来就常见的现象,但是对于热的本质,直到1840年左右还没有弄明白。十八世纪末叶,大多数科学家接受了热质论。热质论将热看作一种假想流体,在热传导过程中,它由热物体流向冷物体,由热物体失去的热质的量等于冷物体获得的量。这种理论认为热质的总量在所有过程中守恒,因而当物体在高温时所含的热比冷却下来后所含的热要多。英国科学家Joule在1840年进行了一系列有关热-功转化的实验,证明物体由于受热面发生的变化,在没有热量传递的情况下通过对物体作机械功也同样能发生。最典型的实验便是对液体用搅拌的方法,使机械能转化为内能,也可使液体的温度升高,此过程中并没有热质流入液体。Jouler的实验结果宣告了热质论的破产,证明了热与功一样,都是能量的一种形式。热和功是可以相互转换的,并测定出热—功当量的具体数值。在焦耳工作的基础上,德国科学家Helmhohz于1847年首次明确地提出能量守恒原理,即热力学第一定律。
热力学第一定律的建立使人们对于热的本质具有更清晰、更正确的认识。根据热力学第一定律,热是当不同物体之间因有温度的差别而进行交换或传递的能量,只有当存在温度差时,才有热的传递。如果物体之间温度相等,则没有热量的传递,热只在被传递的过程中存在,因而热是一种过程量。一个物体在热的时候比在冷的时候具有更多的能量,而不能说具有更多的热量。
被研究的系统若经历了某一过程,从一种状态(始态)变化到另一种状态(末态),系统与周围环境之间多少都有能量的交换,使系统的内能发生变化。系统与环境之间所交换的能量,有热(因温差的存在而传递的能量)和功(其他途径所传递的能量)两种形式。而热量计则是用来测量这种能量变化的仪器。
热量计于十九世纪末已经开始得到应用。它是研究各种过程中能量变化的有效手段,热量计在科学研究及工业应用技术等领域均具有广泛的应用,而且,其本身也正在不断地改进和完善,在热量计的发展过程中,采用了许多先进的现代技术,使其变得更精确、更灵敏,应用范围更广泛。
量热法原理根据热力学第一定律,系统中内能的变化等于对外界所做的功,在恒容条件下,其绝热功为ΔU=QV;在恒压条件下,ΔH=QP。系统的内能U和焓H都是不可能测定的量,但是系统从状态1到状态2之间的内能差ΔU和焓差ΔH可以用量热的方法测得。
量热是使欲测定的反应在热容量已知的仪器-量热计中进行,从反应过程中量热计温度的变化来量度反应的热效应,即将热当量K乘以温度变化值,由此就可直接得出反应的热效应(Q=KΔt)。因此,要测量的量是实验过程中温度的变化Δt和量热计的热当量K,另外还需要准确地确定参加反应的物质的数量和状态。
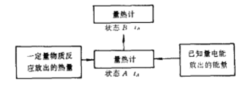
近代量热方法的基本原理,主要是在一个量热计内,将一定量物质在化学变化或物理变化中所吸收或放出的热量,与一定量电能或已知反应放出的热量相比较,此原理可用上图来说明。图中A代表量热计的初态,温度为tA。B代表量热计的末态,温度为tB。设一反应为放热反应,当一定量物质在量热计内反应后,量热计的温度由初态tA升至末态tB,放出热量为Q,则:
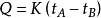
因为近代电能测量能够达到很高程度的准确性,为了测定量热计热当量尺,在同一量热计中输入一定量的电能Qe使量热计温度由同一初态tA升到同一末态tB。
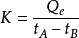
上述量热原理,同样适用于吸热反应,此时,只是在反应进行时不断输送一定量电能,使量热计的温度始终保持不变。则当反应完了后,所输入的电能就等于反应吸收的热量,其原理如下所示:2

量热计量热法所用的主要仪器是热量计。热量计的种类很多,从不同的角度出发,对热量计可进行不同的分类。
从研究对象而言,热量计可分为两大类:一类是测量有化学反应过程热效应的热量计;另一类则是测量无化学反应发生的物理过程热效应的热量计。第二类热量计最广泛的用途是测量各种物质在不同温度范围的热容和焓变。焓变的测量中还包括各种相变潜热,如挥发、熔解以及固体的晶形转变等等,这些相变一般都可以认为是在可逆条件下进行的。对于纯物质,若测定出其从低温到高温范围的焓变和热容,由这些热数据可以直接汁算出物质的规定焓和规定墒。反应热量计的研究对象是有化学反应发生的系统。凡在热量汁中进行的化学反应均为不可逆过程,因而,这类热量计通常只能测得化学反应的焓变或内能的变化,只有某些热量计(如滴定热量计)才可能在合适的范围内,通过对热谱曲线的处理,求算出反应的Gibbs自由能和墒的变化。反应热量计所研究的化学反应包括:固态、液态及气态物质的燃烧反应、液—液相反应、气体或固体在液体中的溶解热,液体物质的混和热等,现代量热法的研究领域还扩展到生物化学及农业等学科,如生物活性的监测,种子生长过程等。
按热量计的测量原理,又可分成两类:补偿式热量计和测量温度差的热量计。在进行量热实验时,反应系统的变化过程所伴随的能量变化会引起量热系统温度的变化,补偿式热量计则是设法对反应过程的能量变化进行补偿,使量热系统的温度一直维持不变,测量过程中所补偿的能量即等于反应系统所释放的能量。能量补偿的方法又可分为相变补偿、Peltier效应补偿和化学反应补偿等方法,但后两种补偿方法已很少采用。测量温度差的热量计又分为两类:一类是测量系统温度随时间的变化,要测定反应系统能量的变化,还必须测定系统的热容。另一类则测量不同位置的温度差,从而测量系统能量变化值,这类热量计多为热导式热量计。
按照热量计的操作类型,又可分为四种不同的类型:
等温热量计,即在测量时,量热腔与环境的温度保持不变,相变热量计是典型的等温热量计;
具有恒定温度环境的热量计,这种热量计的量热腔与环境之间具有良好的隔热层,但或多或少有“热漏”存在。一般的反应热量计、弹式热量计等均属于这类热量计:
热导式热量计,在进行测量时,这类热量汁的温度变化很小,且反应前后温度相等,因而基本上可以认为热导式热量计是在等温条件下进行测定的;
扫描式热量计,其环境与系统的温度随时间按事先规定的程序而变,如恒速升温等,其量热系统由被测体系和参考体系组成,各种热分析仪均属于这类热量计。
热量计虽可按不同的考虑作不同的分类,但这些分类并无绝对的界限,以下对各种热量计分别加以介绍。
绝热热量计一个理想的绝热热量计,在进行量热实验时,反应系统与环境之间应没有热量的交换,欲达到这个要求有两种方法:一是使量热腔与环境的温度完全相等,另一种方法则是使量热腔与环境间的热阻为无穷大,使两者之间没有热的交换,但在实际操作中,完全隔热是无法办到的,因而,绝热热量计均采用第一种方法,使量热腔与环境温度尽可能一致,以达到近乎绝热的目的。典型的绝热热量计原理方框见下图。在进行量热实验时,被测试的样品若释放热量,将会使量热腔整体温度升高,用以感测绝热壁与量热腔之间温差的热电偶会立即感测到温度的变化并立即将此温差信号传至控温系统,控温系统根据温差信号的强弱来控制安装在绝热外壳中的电加热器加热功率的大小,使绝热壁的温度也随之上升,与量热腔外壳的温度保持一致,在整个测量期间,控制绝热外壳的温度均不断地跟踪量热腔的温度,使两者尽可能保持一致,此外,量热腔与绝热壁之间也具有良好的隔热层,因而在量热过程中两者之间的热交换是极小的,可认为基本上是在绝热条件下操作。但在实际上,控温系统不可能作到使量热腔与绝热壁的温度绝对地保持相等,总会有所波动,这种温度的波动总会带来少量的热的交换,因此在对实验结果进行处理时,应对这少量的“热漏”进行适当的修正。
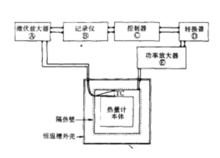
绝热热量计常用来测定物质的比热,测量范围可从低温到高温,在低温范围内(10-350K)。热量计的绝热外壳与量热腔之间常设有真空夹套,以减少因气体的导热和对流而带来的“热漏”。在高温范围内,产生“热漏”的主要因素是热的辐射,对流和导热的影响相对要小一些
等温热量计热电补偿热量计是一种等温热量计,但不是用相变热进行补偿,而是利用热电效应进行能量补偿。若被测量的系统释放热量时,利用Peltier效应,用冷端进行能量补偿,使反应系统的温度维持不变。系统放出的热量可由Peltier效应的致冷量求出。
两种不同的导体连成回路,在回路中用直流电源维持一定电流不断流过时,则导体的一个结头变冷,而另一个结头变热,这种现象便是Peltier效应,其冷端可以吸收热量,热端可放出热量。对于放热反应,可用Peltier效应的冷端进行能量补偿,但对导体自身而言,因电流的通过而存在因电阻引起的热效应,即Joule热效应。Joule效应与Peltier效应是相反的,一为吸热另一个为放热,Joule热效应与电流的平方成正比,而Peltier效应只与电流的一次方成正比,因此,当电流大到某一极限值I0时,两个效应的值相等,总的表观是冷端既不放热也不吸热。只有当电流小于I0时,才能致冷,当电流量为0.5I0时,致冷效果最显著,其致冷量为0.25ηI0,η是Peltier系数,与两种导体的性质有关,Peltier效应的致冷作用受到材料及电流等多种因素的限制,一般说来,其致冷量是不大的。3
应用纯物质热力学数据的测定纯物质热力学数据的测定是量热法最重要的应用领域之一。用量热法测定在298.16K和标准压力下各种化学反应的热效应,便可得到物质的标准生成焓。通过测定等容和等压过程的热效应,可获得物质的内能和焓的变化值。对纯物质,用量热法测定其从低温到高温各温度范围内的比热容Cp,以及在各相变点的可逆相变潜热,便可由热力学第三定律直接求出纯物质的规定熵,这样由量热法求得的熵也称为量热熵,由物质的规定焓和规定熵的数值,就可以获得纯物质的规定Gibbs自由能。在用量热法测定物质的规定熵时,最低温度可测至几K的低温。更低温度范围内的热力学函数值通常可由Debge比热公式计算求出。
各种物质的比热容、相变潜热和诸如稀释、溶解、混合及吸附等物理过程的热效应,基本上是用量热法测定的,这些物性数据,已被制成各种各样的表格,供人们查阅使用。这些最基本的数据不论对于科学研究还是工业生产都是必不可少的,在化工、冶金等工业领域,在建立任何一套生产装置之前,都必须进行工程设计,而设计最基本、最初的程序是要对整个工艺流程进行仔细的物料衡算和能量衡算,物料与能量的衡算正确与否,对于整个工程设计的成败是至关重要的。在进行能量衡算时,则需要有关化学反应的焓变、原料及产物的比热容、相变潜热等等各类数据。在选择工艺流程、确定生产操作指标、估算生产最大产率等方面,物质的热力学数据都是很重要的。
量热法在工业方面的另一重要用途是测定各种能源原料的发热量,这些原料有:原油及天然气、各不同产地的煤,石油工业的系列产品如汽油、煤油、柴油、液化石油气及其他燃料等。燃料产品发热值的大小是鉴定原料质量高低或判定产品是否合格的重要依据。出售燃料产品的厂商须对其产品的发热值给出最低保证值,因此,在燃料工业上广泛地采用热量计来测定产品的发热量,以保证产品的质量。
随着人们生活水平的提高,对自身摄入的营养愈来愈讲究,为了保持人体处于良好的能量平衡状态,必须对所摄入食物的能量作准确的计算。因此,量热法已广泛用来测量各种食物的发热值。人们便依据这些数据制定食谱以保证每天摄入适当的能量。同样,在畜牧场内,也依据这些数据为家畜配制饲料。用量热法研究易爆易燃等危险化学品的性质,对如何安全的处理和运输这些化学品是十分重要的。
热分析、热滴定方面的应用扫描式热量计,特别是热分析仪器的应用领域已远远超出量热的范围,在动力学和测定物质理化性质方面,已得到广泛的应用。
应用差热分析热谱曲线,可鉴定各种物质,不论是无机物还是有机物,都具有特征的DTA曲线,它们像“指纹”一样表征物质的特性,目前已出版了各种化合物的标准热分析曲线图谱集,以便于鉴别矿物、无机物、有机物及高聚物等化合物。
应用DTA和DSC可测定固体及液体的比热容、液-固及气-液等一级相变的相变温度和相变热以及各类二级相变如固态晶形转变、磁性转变和玻璃化转变的转变温度等。
矿物、无机盐类以及有机化合物在高温下会发生分解,将TDA、DSC和TG法联用,可以对化合物热分解反应的温度、产物、分解速率、反应活化能和反应机理进行测定和分析。Freeman和Caroll于1958年提出了从热重曲线求反应级数和活化能的方法,后来,Sharp和Doyle等人也提出各自的处理方法。
热分析很早就应用于金属学领域,用来测定金属熔点等,现在,它已成为研究合金相图的主要手段,用热分析法除可获得平衡相图所需的各种数据(如步冷曲线)外,还可得到合金的热力学数据、判断亚稳相存在与否以及决定亚稳相的溶解度曲线,
晶体的熔点是很敏锐的,当晶体中掺有少量杂质以后,其熔点范围会明显扩大,使得DSC热谱曲线上的相变吸热峰的宽度和高度发生明显的改变,利用这一特点,用DSC法可鉴定化合物的纯度,这种方法操作简便,速度快,用量少,它已成为鉴定有机化合物最有效的方法。
热滴定也称为温度滴定、热焓滴定等,所采用的手段是滴定热量计。化学分析所涉及的酸碱反应、沉淀反应、氧化还原反应和配合反应等,均伴随有一定的热效应,当反应一开始,便有热量产生,当反应终止时,热效应也随着结束。滴定热量计的感温元件(热效电阻)热容很小,能对温度的变化作出迅速响应,因而量热滴定可用作化学分析的有效手段,并在冶金、煤炭、造纸、制药和生物制品等工业方面得到应用。有些化学反应由于平衡常数的限制,在量热滴定中反应不能完全进行到底,这时,从反应的热谱曲线中,不仅可获得有关反应焓的信息,还可得到有关熵变及反应平衡常数的信息。
生物学方面的应用生物体内所发生的过程往往不但热效应小,而且非常缓慢,传统热量计对这类过程无法进行监测,热导式微热量计的出现和完善,使得对生物体内的过程进行量热测定成为可能,它已用来对生物的活性进行监测。应用热导式微热量计还可测定细菌等微生物的生长热谱、细胞的代谢热谱和种子发芽过程的能量变化。运用热动力学的方法,微量热法可用于酶催化反应的米氏常数和反应焓的测定。
其他应用专门设计的热量计可测量激光束的能量,这种热量计可以为热导式或等温外壳式热量计,具体的结构形式也因接受能量的方式不同而采用不同的设计。激光束能量的大小由电能进行标定。
量热法也可用于微波辐射能的测量,在核能工业领域,量热法也得到应用。热量计不但可用来测定放射源的能量,通过测定放射源的辐射能可以确定放射元素的半衰期,用这种方法可以化验分析放射源中所含的放射元素。3




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国