一年一度的诺贝尔奖颁奖又如期而至,整个世界都在翘首以盼,猜想着这六项不同行业内的最高荣誉到底会花落谁家。
在万众瞩目之中,新一年的诺贝尔生理学或医学奖获奖者浮出水面。
当地时间10月1日上午11时30分,2018年度诺贝尔生理或医学奖揭晓。今年该奖项颁发给了美国免疫学家詹姆斯·艾利森和日本京都大学教授本庶佑,以表彰他们发现了抑制免疫调节的癌症疗法。

那么,他们到底做出了什么样创造性的贡献,我们又如何理解他们的工作内容呢?
癌症作为“不治之症”中最令人闻风丧胆和死亡率最高的病症之一,多年以来一直是医学界研究的重点目标。如何治疗癌症也成为了癌症研究之中最受公众所关注的部分。经过无数医生、科学家多年的不懈努力,包括手术、放疗、化疗在内的多种方法被用于癌症的治疗,也取得了不错的效果。我们面对癌症不再无计可施,也有不少早中期癌症患者在经过治疗后恢复了健康。但是,对于晚期癌症的治疗,医学界一直没能拿出一个较为有效的办法,现有的绝大多数治疗方法也只能延长晚期癌症患者的存活时间,患者想要康复还是只能祈祷“奇迹”的发生。而癌症难以筛查发现的特性使得很多癌症患者一经发现就已经到了晚期,错过了治疗的最佳时机。因此,癌症依然是我国居民死亡的首要原因。
而本次诺贝尔生理学或医学奖就与晚期癌症的治疗有着密切的关系,癌症的免疫疗法或许就是癌症治疗的未来。
19世纪末,一名叫做威廉·克莱的医生在分析了大量癌症病例之后,得出了一个看似“逻辑不通”的结论:恶性肿瘤患者在感染之后似乎癌症症状会有所缓解。为什么感染对于虚弱的癌症患者来说,并不是“雪上加霜”,而更像是“雪中送炭”呢?这一现象令威廉·克莱十分不解,他决定通过实验来研究这一问题。于是在1891年,科莱医生在一名无法实施手术的晚期癌症患者身上注射了链球菌,并继续观察这位癌症患者的情况。结果令他非常意外的是,这位患者的肿瘤尺寸居然奇迹般的变小了。因此,克莱医生后续又在多名患者身上进行了类似的尝试,并且据他所言,取得了非常不错的效果。但他始终没有想清楚这究竟是为什么,而他的治疗方法也很快被效果更加明显的放疗和化疗所取代。
但免疫疗法并未在历史长河之中消失,而是在默默地向前缓慢发展。
人类的免疫系统大致分为两个部分:非特异性免疫和特异性免疫,而特异性免疫又可以分为细胞免疫和体液免疫。而T细胞则在细胞免疫中扮演着非常重要的角色,它可以特异性识别并消灭被感染的细胞,可以辅助抗体的产生……多种不同的T细胞是免疫系统中不可或缺的一个部分。
而这个诺奖,也是由T细胞担任主角。
早在上世纪九十年代,人们就发现,有些T细胞可以表达出一种叫作CLTA-4的蛋白质,这种蛋白质作为受体,可以抑制T细胞免疫反应的激活,就像是一个“刹车”一样。相应的,T细胞上也存在着类似的“油门”蛋白,可以激活T细胞的免疫反应。这两种蛋白同时存在于T细胞表面,通过与不同信号分子结合,相互制约,共同调控T细胞的免疫反应。换句话说,这两种不同的蛋白就像是T细胞的两种不同人格,一种大叫着:“冲啊!敌人都侵犯到你面前了,快去干掉他!”而另一种则劝道:“莫生气,莫生气,你看错了,那是自己人。”这两种“人格”使T细胞在快速杀伤病原体的同时,不会因为一时冲动把自己人也给顺手干掉了。
这次诺奖的获奖者之一,艾利森的实验室很早之前就开始研究CTLA-4蛋白的功能了。当他发现CTLA-4蛋白可以抑制T细胞的免疫反应激活时,他就开始考虑,这种蛋白是否能够应用于癌症的治疗呢?他计划开发出一种特殊的抗体,这种抗体可以能够抑制CTLA-4蛋白的功能,从而解放T细胞,使其高效地杀伤癌细胞。他设想中的抗体可以通过与CTLA-4蛋白特异性结合,使本该与CTLA-4蛋白结合的信号分子失去“位置”,导致“刹车”被松开,而“油门”则继续发挥作用,T细胞被激活。1994年,他给患癌小白鼠注射了人工合成的CTLA-4抗体,发现实验小鼠的肿瘤有了明显的缩小。
再后来,他和他的合作者成功制造出了可以用于人类的CTLA-4抗体——MDX-010,或者叫“伊匹单抗”。临床实验结果显示,伊匹单抗对于黑色素瘤有着非常优秀的治疗效果,它大大提升了黑色素瘤患者的存活时间。
这种药物对于晚期癌症患者来说无疑是一种福音,因为其他治疗方法对于这些患者大多已经完全无法起到作用,而伊匹单抗大大延长了患者的存活时间。
而几乎与艾利森的发现同时,在1992年,日本的免疫学教授本庶佑发现了T细胞上的另一种“刹车”蛋白质——PD-1。PD-1和CTLA-4蛋白有着相似之处,都能抑制T细胞的免疫反应,但作用机理有所不同。PD-1被认为与细胞的程序性死亡有着密切的关系,当PD-1与信号分子结合后,T细胞就会启动程序性死亡流程。所以PD-1并不能算是“刹车”,而更像是一种“自毁程序”,当PD-1这种极端“人格”被激活之后,就会给T细胞传递这样一种信息:“你去死吧!”,T细胞也会乖乖地“自杀”。
很多癌细胞为了保护自身,也进化出了类似的伪装机制。癌细胞上的某些分子可以起到信号分子的作用,于是癌细胞就可以将人体中的T细胞消灭,使自己存活下来。
在PD-1被发现之后,有多种针对它的抗体被相继研制出来,这些抗体也在临床试验中取得了非常好的效果。
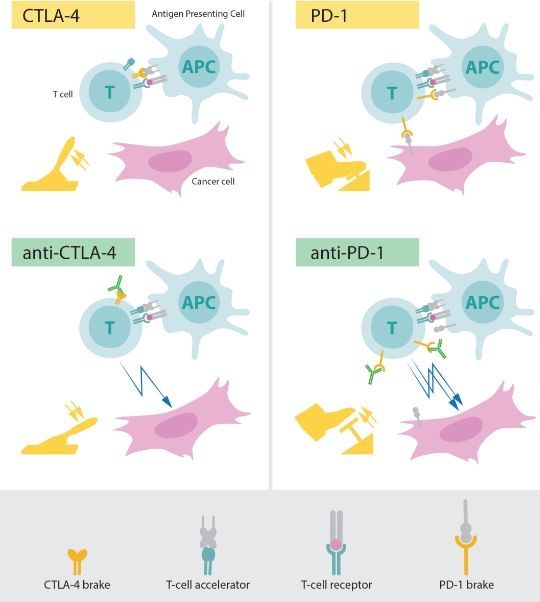
但这两类抗体药物并非完美无缺。由于T细胞的免疫机制被激活,过度活跃的免疫反应会在消灭癌细胞的同时杀伤自身正常细胞,严重的可能造成自身免疫疾病的发生,这种副作用几乎是危及生命的。好在目前来看这些副作用并不会持续发生,只会在使用药物后的一段时间内出现。和它优秀的效果相比,这些副作用也是可以接受的。当然,接下来的研究方向也包括了进一步阐明这两种蛋白的作用机制,以寻找减轻副作用的方法。
新的临床研究表明,针对这两种蛋白的联合疗法会更加有效。除研究中常用的黑色素瘤之外,联合疗法也对肺癌、肾癌、淋巴瘤有着不俗的效果。另外,科学家们也在寻找其他可能的蛋白质作为新的抗体靶标。
癌症的治疗是一项任重道远的事业,免疫疗法无疑为未来的癌症治疗找到了一条光明的道路,无论是理论研究还是药物开发都在如火如荼的进行着。但对于普通人来说,仍有一个非常严重的问题存在——买不起药。由于药物的开发成本非常高,每一疗程的药物价格也及其昂贵。据估算,PD-1治疗每年所需的费用超过四十万(针对不同情况费用会有所变化,但大体是不会低于这个价格的),这对于绝大多数普通民众来说是难以承受的。类似《我不是药神》中,有药可医但无钱可买的情况仍然是很多癌症患者家庭所遇到的最大问题。药物成本的压缩也成了药物开发环节中不可缺少的一环。
癌症治疗的未来是否就在免疫疗法这条道路上呢?我们拭目以待。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国