对于人类来说,癌症是一个可怕的词。因为癌症的复杂性,无论对其进行治疗还是预防都十分困难。而科学家们也一直在尝试各种方法,试图遏制癌症对人类的伤害。最近,我国科学家在《国家科学评论》发表了癌症新疗法的前沿成果,这项技术先把一种特殊的感光化合物定向输送到癌肿部位,再用特定光源在体外进行照射。结果发现,该化合物在光照下会持续释放对癌细胞有强烈杀灭作用的活性产物,而正常细胞则几乎不受影响。
在对小鼠进行的实验中,这一疗法表现出了惊人的疗效。仅需一次时间为10分钟的光照治疗,感光化合物就会在肿瘤处持续发挥作用。接受治疗后50天,患癌小鼠存活率从0增加到100%。而且论文中明确表示,这项技术对正常的身体细胞没有影响。
对癌细胞高度敏感,而对普通细胞又损伤极小的神奇物质,为何能够精准定位、直捣黄龙。光照下释放出的活性产物又是何方神圣,能让顽强的癌细胞一命呜呼?这项研究带来的意义有多大,人类真的掌握了癌症治疗的神功秘法?今天这篇文章就为大家揭开上述疑问的答案。

新闻截图,来源:新浪微博
传统抗癌疗法,虽然有效但副作用不小
传统的癌症治疗手段除了外科手术切除,不外乎放疗和化疗两种。外科手术对人体伤害很大,且术后也不免需要放疗化疗来巩固治疗效果。放疗主要利用各种类型的放射源对癌症部位进行照射,以借助放射线杀灭癌细胞。而化疗则通过各种对癌细胞存在抑制作用的化学物质来起到抗癌作用。不过,无论是放疗抑或化疗,都存在敌友难辨的问题。即正常细胞也会随同癌细胞被一起攻击,后者作乱前者背锅,最终在患者身上产生各种难熬的副作用。
况且,癌细胞可不会甘心接受被剿灭的命运,它们的求生本能可是不容小觑。外界不利条件一来,癌细胞立马会求变自保,经常在短期内就演化出具备抗药性的新一代细胞。最终,多种针对癌症的化学疗法都面临初期有效,后期效果越来越不明显的困境。
因此医学界一直在努力寻找副作用相对温和,且难以产生抗药性的癌症治疗方式。科学家们的努力没有白费,各种前沿技术相继进入我们的视野。并且值得一提的是,光在这类疗法中扮演着重要的作用。
简单粗暴的光热疗法
既然说到了光,我们不妨在正式的介绍开始之前,先来想想光都有哪些特质,或者说光照射到物体后,会激发起怎样的反应。首先,生活经验告诉我们,光的照射会让物体温度升高,比如太阳直射的地方就要比阴凉地的温度高上不少。此外,光的照射还会让物质的性质发生改变,比如塑料和橡胶的老化会在光照下显著加快,而人如果不注意防晒皮肤则会被晒黑。
这些事例说明了光作用于物体后的两大效应,第一产生热量,第二激发化学变化。癌症的各种光疗法正是基于这两种效应,前者称为癌症的“光热疗法”,后者称为癌症的“光动力疗法”。
光热疗法原理非常简单,实现起来也不算困难。科学家们将金属、金属氧化物或者石墨烯的纳米级颗粒注射到癌症部位,然后再在体外用特殊光线对其进行照射。这类纳米颗粒有个非常有趣的特性——容易吸收特定波长光子的能量,继而发热。最终,它们将在体内癌肿部位产生42摄氏度左右的高温。与正常细胞相比,癌细胞更加怕热,这一温度将加速癌肿细胞的死亡,而正常细胞则尚且能够耐受,如此一来,癌细胞就可能被活活烤死。
进化出耐热基因显然不那么容易,简单粗暴的光热疗法对癌细胞的杀伤力很大,而且上述的无机纳米颗粒们还具有很高的能量转化效率,用不着海量的注射就能对癌细胞形成强烈的“炮烙”效果。不过,光热疗法目前面临着一个相当大的困难:将这些物质注射进体内很容易,但请神容易送神难,最后怎么把它们代谢出去是个大问题。数以亿计的纳米颗粒们最后可能随着血液循环周游全身,最后在大脑,肾脏等关键器官沉积,造成难以去除的慢性中毒。虽然有一些有机化合物同样能够产生光热效应,且能够被身体代谢排出,但它们的热效率太低,且合成困难。
肿瘤光热疗法示意图,来源:Freepik.com
名字很“中二”的光动力疗法
光动力这个名字听上去有点中二,实际上它的得名过程本来就自带玄幻属性。1897 年慕尼黑大学的Tappeiner教授与他的学生Rabb,利用吖啶(acridine)和草履虫做实验,结果却意外发现,吖啶加上光照后会对草履虫产生强烈的毒性,毒性远大于双方的单独影响。他们推测此效应可能是能量从光转移至化学物质上,于是将此效应命名为“光动力作用”(photodynamic action)。
传统的癌症光动力疗法主要利用光照射特殊的感光化学物质后产生的活性氧,而活性氧类物质对于细胞有很强的伤害性,集中释放于肿瘤处足以让癌细胞“喝上一壶”,并且癌细胞很难对其产生抗药性。一个有效的光动力疗法至少得包括如下的三个要素,第一,感光剂;第二,能够让感光剂被激发的特殊波长光波;第三,细胞内的氧分子。前两个要素都好理解,氧分子在其中扮演什么角色呢?感光剂在光照下释放的能量会将氧分子激发为活化状态,形成活性氧类(ROS)物质,包括氧自由基和单线态氧等。因此,细胞内的氧分子同时扮演了为光动力疗法提供弹药的角色。
利用光动力疗法治疗某些癌症的成熟方案已经在临床上应用了很多年,它对各种皮肤癌的治疗效果尤其明显。不过光动力疗法也有自身的局限,首先,活性氧人挡杀人,佛挡杀佛,副作用虽小但还是难以避免;其次,肿瘤组织属于缺氧环境,这又会大大限制活性氧的产生。
利用激光进行光动力疗法的示意图,来源:公有领域
中国科学家独辟蹊径,“光催化”疗法治好患癌小鼠
光催化疗法同样是利用光来照射特殊的感光剂,但对癌细胞产生杀灭效果的并非是活性氧,而是光催化发生时产生的大量空穴。光中的光子提供的能量,可以让感光剂中的部分电子发生跃迁(可以认为是能量变高后从原来位置逃逸)。跃迁后原本电子存在的地方就会变成一个带正电的光生空穴。光生空穴和活性氧一样,都是具有强烈氧化性的物质。但有所不同的是,光生空穴的产生过程并不依赖氧分子,这是光催化与光动力疗法的显著区别。
本次研究能够成功关键在于,中国科学家们在不久前发明了一种可以大量制造感光剂Nano-SA-TCPP的方法。该感光剂的中文名称非常长,叫做纳米级自组装四羧苯基卟啉,结构也非常复杂,因此它被归类到“超分子化合物”中。
Nano-SA-TCPP有很多神奇的性质,首先,当在420到750纳米波长范围内的光照下,它释放出的光生空穴具有“令人惊异”的强烈氧化性。其次,由于具有所谓的“尺寸选择效应(size selection effect)”,Nano-SA-TCPP几乎无法进入普通细胞,而只会定向进入癌细胞。最后,它释放的光生空穴,在癌细胞内会造成细胞膜破裂,细胞质流失等效果。
在小鼠实验中,小鼠身上的实体瘤(尺寸约100立方毫米)仅需接受10分钟的光照就会逐渐开始萎缩。治疗当天,肿瘤外观的就有肉眼可见的缩小和平坦化。治疗后第二天,患处会发生结痂,结痂约一周后脱落,露出完好的新生组织。而接受同样疗法的健康小鼠则没有任何异常的迹象。
此外,研究人员在一系列肿瘤细胞系中进行了类似的实验,均取得了非常理想的抗癌效果。
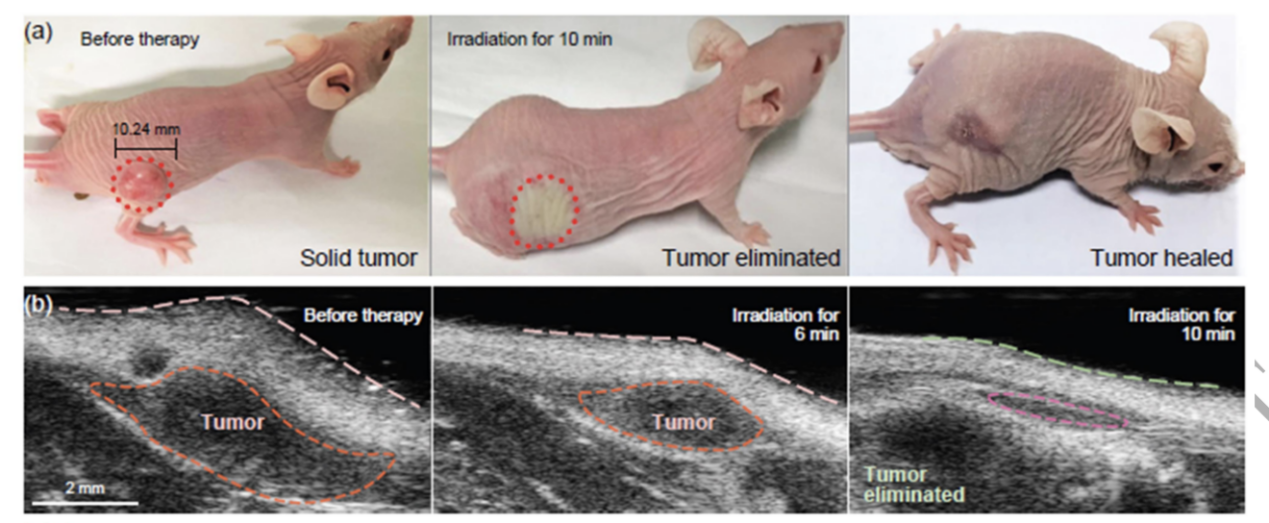
小鼠接受不同时间光催化治疗后的肿瘤萎缩情况,来源:参考文献1
新疗法虽然鼓舞人心,但仍然应该谨慎乐观
这项成就被媒体广泛报道后,很多人都在社交媒体上表达了自己的激动和兴奋,甚至有人说2020年是人类彻底征服癌症的元年。虽然中国科学家取得突破可喜可贺,但“彻底征服癌症”这样的说法多少还是有些言过其实。
首先,各种癌症的光疗法都存在一定的辐照深度问题,如果肿瘤出现在体表,光疗法当然有施展的可能,但大部分肿瘤隐藏在人体内部深处,这样的肿瘤很可能让光疗法无能为力。即便假设我们能够在打开人体内部并暴露肿瘤后再进行光照治疗,理论上似乎解决了光辐照深度的问题。但这样复杂的手术及之后病人面临的风险很可能与传统的肿瘤切除手术并无二致。光催化疗法未来是否能够发展到可以探讨类似治疗方案的成熟水平,尚不得而知。
其次,光催化疗法虽然对杀灭癌症细胞异常有效,但它的作用方式(直接把癌细胞的细胞膜弄破,让其细胞质流失)却有些过分刚猛,这反而不见得总是好事情。为什么这么说呢?大家可能听过挤压综合症这一病名,比如在地震等事故中肢体被压住的时间过长,受压处的组织细胞将会缺血、死亡并破裂。随之释放的毒性物质会随血液流向全身,引起机体内部的免疫反应。作为本次实验对象的裸鼠免疫力低下,肿瘤消散过程中引发的免疫反应可能比较微弱,但换成拥有正常免疫力的小鼠,很难说是否可以经受得住癌细胞破裂过程中所释放的大量有害物质。
最后,作为一项仍然处在早期发展阶段的癌症治疗手段,光催化疗法仍然需要面对一系列的有效性、安全性评估。这背后需要实验室、企业乃至国家监管部门的大量工作,绝非朝夕之功。
无论如何,人类在面对癌症时能有更多的疗法选择,无疑是黑暗中难得的光芒。正如论文摘要中所说:“光催化疗法的高效性、安全性和普适性,将为我们提供一把征服癌症的新型手术刀”。
参考文献:
1.Photogenerated holes induced rapid eliminating of solid tumors by the supramolecular porphyrin Photocatalyst
https://academic.oup.com/nsr/article/doi/10.1093/nsr/nwaa155/5866536




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国