一直以来,科学工作者们不断努力,攻破了临床医学上的一个又一个难题,为以往难以治疗的疾病带来了治愈的希望。近日,全球首例使用iPS细胞进行角膜再生的临床移植手术在日本大阪大学成功进行,该研究为角膜疾病患者带来了新的曙光。

日本国立动物医院对小型动物进行眼角膜移植前后的对比照片和染色照片
(图片来源:https://www.cellseed.com/product/img/CellSeed_New_Brochure01.pdf)
供体短缺——角膜移植的“拦路虎”
角膜是眼球前部的透明圆顶状膜。这个半毫米厚,一厘米直径的薄膜,组成了完整的眼外壁,具有强大的聚焦功能,其作用包括透光、折射光和防止异物进入等。当角膜由于炎症、外伤或者遗传疾病等因素变得混浊、不能正确折射光线或者有孔破损时,视力将严重受损,甚至致残致盲。角膜病是仅次于白内障的第二大致盲眼病,患者人数众多。目前,角膜移植手术是治疗与角膜相关疾患的有效方法。

人体眼球结构示意图,作者:Rhcastilhos
(图片来源https://zh.wikipedia.org/wiki/%E8%A7%92%E8%86%9C)
然而,角膜移植最大的问题便是供体的缺乏。角膜移植需要去除失去功能的角膜,并缝制新的供体角膜。通过角膜移植可以治愈75%的角膜疾病。由于角膜上没有血管、淋巴,移植后机体免疫排斥反应相对较低,也不需要血液型配对。因此,相比技术而言,供体角膜的短缺是阻碍患者重见光明的主要因素。
现阶段,角膜主要供体来自于死者捐献。据统计,中国有400-500万左右的角膜疾病患者,其中能得到角膜移植的患者不足1万人,甚至不到患者总人数的百分之一。日本每年有2万只眼睛需要移植角膜,而实际上能够进行手术的供体数量只有1400片。
对于一些急性角膜疾病患者来说,如果不能在3-5天内得到新鲜的角膜,会导致角膜穿孔感染,进而导致视网膜受损,到最后很可能必须摘除眼球。在中国,由于供体严重不足,如果不是急性患者一般都要等上1-3年。很多病人因此延误治疗时机,造成终生失明的遗憾后果。
猪角膜代替人角膜解决供体问题?免疫排斥来搅局
鉴于角膜移植存在严重的供体短缺问题,科学工作者始终致力于寻求别的方法和技术来代替新鲜的人体角膜。
人们首先想到的解决方案是动物角膜,最常用的是猪角膜。猪角膜在形态上与人角膜的相似度可以达到94%。然而,由于是“异种异体移植”,免疫排斥问题将十分严重。同时,如何去除猪角膜上携带的各种病原菌、寄生虫等微生物仍然是一个有待研究的问题。
相比猪角膜移植术,人工眼角膜作为另一种解决方案无疑获得了更超前的进展。2018年6月,英国纽卡斯尔大学的研究者们用3D打印技术造出世界首例人工眼角膜。他们用健康人角膜中提取出的干细胞,混合胶原蛋白和藻酸盐,仅用10分钟就得到和患者同样尺寸和大小的人工眼角膜。尽管该技术应用了人体来源细胞,有望抑制排异反应,但是由于缺乏确实的体内实验,这项新技术用于临床研究仍然需花上数年的时间。

NEWCASTLE UNIVERSITY
(图片来源 https://www.huffingtonpost.jp/2018/06/03/3d-print-cornea_a_23449897/)
什么是iPS细胞?
iPS细胞(induced pluripotent stem cells),全称人工多能干细胞,是将皮肤,血液,尿液等中提取的体细胞,经过多能性诱导因子的导入、培养,所制成的具有分化成人体各种组织脏器并能无限增殖的细胞。iPS用于临床最大的优势即是可以“同种同体移植”,从而最大程度减少免疫排斥。
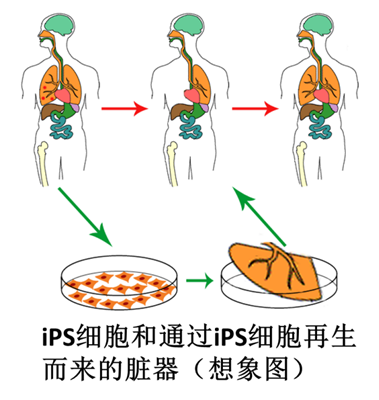
iPS细胞的全能分化能力(示意图)
(图片来源:维基百科)
iPS****细胞由来的角膜如何用于移植?
由iPS由来的角膜细胞也属于生物工程类人工眼角膜。就在不久前,日本大阪大学医学院的西田幸二教授领导的研究小组宣布他们利用iPS细胞制成的眼角膜完成了世界首例iPS眼角膜移植手术。
今年7月,他们将iPS由来的角膜上皮细胞薄片给患有角膜上皮干细胞缺乏症的患者进行了移植。这种疾病的致病原理是:富含角膜上皮干细胞的角膜边缘部,由于烫伤,酸碱腐蚀,Stevens-Johnson症候群(一种罕见的皮肤黏膜坏死症)等原因,角膜上皮干细胞部分甚至完全缺失。其后果是结膜上皮侵入角膜内,血管等结膜组织覆盖在角膜上层导致角膜呈现重度浑浊,引起视力障碍和失明。
移植手术于今年七月在大阪大学医学院成功实施,患者视力得以恢复,已于8月23日出院。如果该患者预后良好,视力得以长期保持,则年内还会进行第二例移植手术。
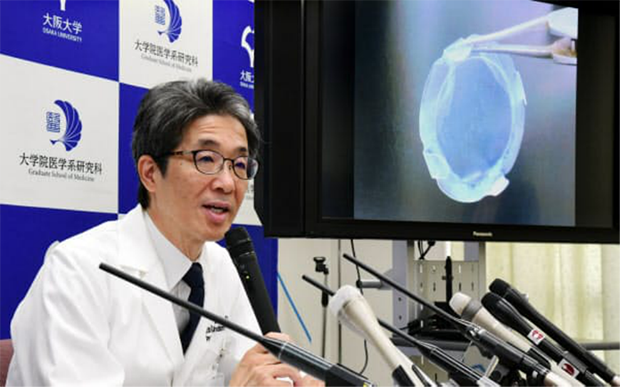
西田幸二教授召开关于首例使用iPS细胞进行角膜移植手术的记者招待会
(图片来源:https://www.nikkei.com/article/DGXMZO49163170Z20C19A8000000/)
由iPS细胞如何得到角膜薄片呢?首先选择和患者具有同一HLA型(人白血球型抗原,是人体识别自身和异己的最主要因子,在脏器移植时HLA匹配度高的患者,移植的成功率也越大)的健康人的iPS细胞,再将这个iPS细胞株,用西田教授小组开发的SEAM法(self-formed ectodermal autonomous multi-zone自我形成的眼外细胞的外胚层自主多区法)进行分化,以得到角膜上皮前体细胞。
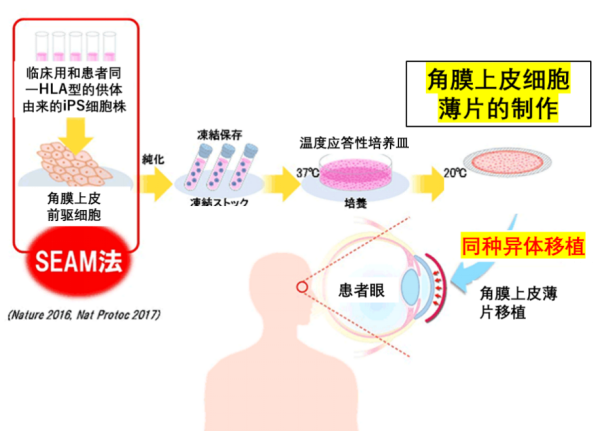
角膜上皮细胞薄片的制作 (图片来源:Nature 2016. Nat Protoc 2017)
如下图所示,利用这项技术,经过40天的人工培养,iPS分化成同心圆细胞层。这个同心圆细胞层几乎完全再现了眼睛的多层结构特征,包括表皮,角膜上皮,晶状体,神经视网膜和视网膜色素上皮层。下图中第三层外缘就是我们想要的角膜上皮细胞。之后再将这部分细胞从中分离出来并加以纯化。

由iPS细胞分化成的四层眼前体细胞,这些细胞是胚胎发育初期,形成眼部结构的初期细胞,包括表面外胚叶、眼表面外胚叶、晶状体、眼杯、神经外胚叶细胞。这些细胞随着胚胎的发育会依次形成构成表皮、角膜上皮、晶状体、视网膜、网膜色素上皮、以及视神经等成熟细胞。
(图片来源:https://www.jst.go.jp/pr/announce/20160310/index.html)
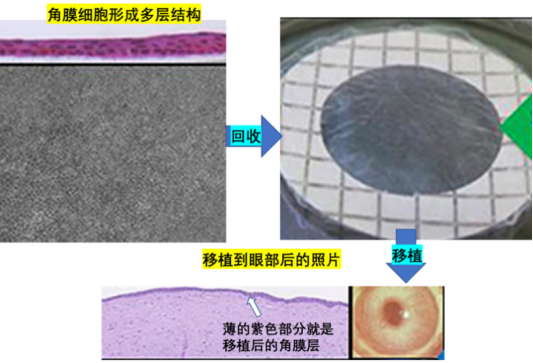
接着,再将分离纯化后的角膜上皮前体细胞进行扩大培养,令角膜上皮细胞自行生成多层结构,当达到一定的厚度时,即可用于移植手术。
(图片来源:https://www.jst.go.jp/pr/announce/20160310/index.html)
除了从iPS细胞获得高浓度有活性的角膜上皮细胞层这个技术难关外,另一个需要解决的难题是怎样回收这个角膜细胞层。为了从平面培养皿上获得一个完整的多层细胞结构而不破坏生长中的新鲜细胞,科研工作者付出了艰辛的劳动。
如下图所示,当使用通常的细胞培养皿和胰蛋白酶进行细胞分离时,细胞会被分散成各自独立的细胞。好不容易得到的多层角膜层不能保持完整的结构,当然也不能用于移植。因此,科研人员尝试在普通的培养皿表面涂上对温度敏感的化学聚合物(PIPAAm),希望仅通过温度变化就实现细胞薄层的分离。当温度在37度时,这些聚合物和细胞紧密结合,当温度从37度降到20度左右时,这些化学聚合物发生变性,和细胞之间的结合能力变弱,由此即可轻松获得完整的细胞薄片。

(图片来源: https://www.funakoshi.co.jp/contents/67935)
iPS****细胞治疗眼部疾病已获丰硕成果
iPS细胞在眼部疾病上的临床应用,除了这次角膜移植手术,在2018年日本已经实施了iPS由来的细胞对视网膜黄斑变性的临床治疗。和这次的方法有所不同的是,由iPS细胞分化得到的视网膜细胞当时是以悬浮液的状态注射到患者的眼中进行的。
这项研究由日本理化学研究所高桥教授领导的研究小组进行,他们在2017年3-9月间,将25万个由iPS分化得到的网膜细胞移植到60-80岁的5位男性眼内。之后为期1年的安全性追踪结果显示,移植细胞没有在患者体内形成肿瘤等严重不良反应,5人中有一人有轻微的排斥反应,已通过药物治疗得以缓解。5人至今都较好地维持了视力,这也证明了iPS细胞由来的组织细胞在再生治疗上的安全性。我们期待iPS由来的角膜薄片,也能安全稳定地在患者身上持续发挥作用。
自山中伸弥教授发现iPS细胞以来,日本就将iPS在再生医疗方面的应用列为国家重点发展领域。目前在日本,不仅仅是医学界,生物界,材料工学界,甚至各大药企都联合起来,全力推动iPS的产业化发展。借助产学研的通力合作,如果可以实现iPS角膜薄片的工业化生产,角膜供体不足的问题将会得到根本性地解决,会有更多的角膜疾病患者得以重见光明。
参考文献
[1]Ryuhei Hayashi & Kohji Nishida et al.Co-ordinated ocular development from human iPS cells and recovery of corneal function. Nature volume531, pages376–380 (17 March 2016)
[2]3D打印机制作眼角膜
https://idarts.co.jp/3dp/famu-3d-printing-cornea-technology/
[3] Hayashi R et. al. Coordinated generation of multiple ocular-like cell lineages and fabrication of functional corneal epithelial cell sheets from human iPS cells 2017 Nature Protocols
[4] Cell sheet engineering, Masayuki Yamato,Teruo Okanoa.MaterialsToday,Volume 7, Issue 5, May 2004, Pages 42-47




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国