1487年的一个幽静的夜晚,达芬奇醒了,虽然只睡了半个小时,他依然精神抖擞, 因为他要完成一项他期待已久的实验--找到“灵魂”所在。
他的实验对象是只青蛙,原本期待着能像罗马历史学家李维(Livy)笔下描述的那些驱象人一样:“用锋利的尖物刺在双耳中间脖子与脊柱相连的位置,可以给予大象最迅速的死亡。”然而大象太庞大了,他无法确定自己什么时候能制作出与其体积相配的实验手术刀。根据罗马军事作家韦格蒂乌斯(Vegetius)在《罗马军制论》的详细描述,他可以轻易地制作一把适用于青蛙的手术刀。
在实验过程中,选取脊髓作为损伤位点不仅仅是出于猎奇,“原动力(generative power)”--他记得柏拉图在蒂迈欧篇里就是这样描述脊髓的,他猜想那里一定隐藏着生命与灵魂的秘密。几个小时后,当他准备再次小憩时,达芬奇激动地记录下了今天的实验结果:“青蛙可以在头部、心脏以及所有的内脏去除后依然能存活几个小时,但如果你刺穿脊髓,青蛙立刻抽动并且死亡。”

红色粉笔画的肖像,画于大约1512年至1515年,被广泛视为最初的达芬奇自画像。意大利文艺复兴时期的一个博学者,与米开朗基罗和拉斐尔并称文艺复兴三杰。(图片来源:totallyhistory.com)
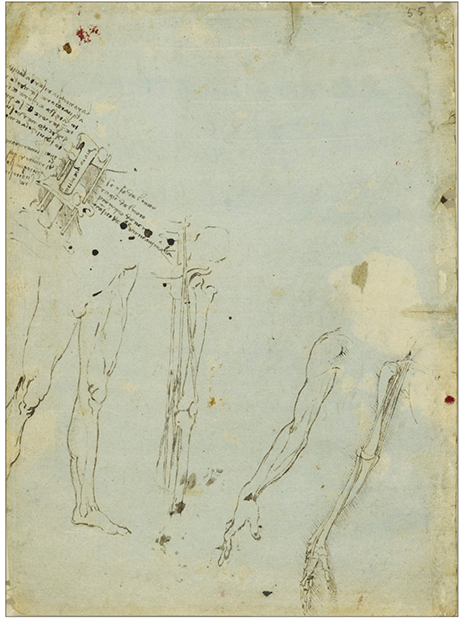
达芬奇手绘的被刺毁脑脊髓的青蛙的脊柱。左上是颅骨底部与穿过枕骨大孔的脊髓部位分解图。沿着脊髓上的文字标记着“原动力”(译)。脊髓左边的是达芬奇常用的镜像文字,右边文字罕见的以正常方向书写,包括“触觉,运动之起因,神经之起源,动物力量之通道”。下面一排图示描绘了腿部、手臂和骨头的周围神经[1]。
这个实验结果对达芬奇来说是超出预期的,因为按照当时的传统观点,头颅、心脏或者是肝脏被认为是生命与灵魂的基石,然而达芬奇却发现即使移除这些器官也并未能迅速的杀死动物。
就这样,作为有记载的第一个脑脊髓刺毁法的实验者,达芬奇认为他发现了动物的“运动和生命的基础”。虽然他对“灵魂”探索还在继续,但这位文艺复兴时代的艺术家兼科学家对脑部的探索,解放了人们对大脑、运动与生命的懵懂认知。
出生前,你已经能完成多种运动
我们常听到一句口号—“生命在于运动”,这种说法是源于法国启蒙时代的思想家伏尔泰。尽管对已故伟人冠名宣传的做法已屡见不鲜,但运动确实出现于生命伊始。早在胎儿时期,我们就已经可以完成多种运动,最常见的就是腹中的孩子调皮地踢妈妈的肚子。
有趣的是,这类早期行为并不是灵长类独有,鸟类在胚胎时期也可以移动和发出吱吱叫的声音。研究表明,频繁的吱吱叫或者在蛋壳内发出咔哒声,有助于加速孵化过程[2]。
手把握反射(palm grasp reflex)是人类早期运动行为的典型例子。如果用手指碰触婴儿的手掌,宝宝的手会立刻弯曲手指并抓住它,如果抓的足够紧,甚至可以短暂的将宝宝提起来。千万别小看这个手把握反射,当年还在树上的老祖宗,就是依靠这项被动技能增加了生存的几率。
手把握反射(https://makeagif.com/gif/palmar-grasp-reflex-c5rYzR?position=2)
运动行为如同神经系统一样,随着发育过程逐渐形成并完善。由于胚胎期和成年期所处环境的迥异,每个动物都会对特定的环境进行阶段性的适应。手把握反射一般出现在婴儿期0到3个月。同样对于人类婴儿,当你轻轻触碰他(她)的脸颊或嘴唇的时候,他(她)就会眯着眼迅速把脸转到你的手指那边,然后做出吮吸的动作,这是一个基本的觅食反射,能保证母乳哺育成功进行。但是如果你这样逗一个5岁的熊孩子,天知道你的手会发生什么。
觅食反射(https://makeagif.com/gif/rooting-reflex-GFTJtP) 除了这些简单反射以外,更复杂运动行为的建立依赖于简单的神经环路从发育到形成最终到整合的过程。20世纪20年代,美国解剖学家Coghill借助蝾螈探索神经肌肉系统的发育过程[3],并结合已有的解剖结构和细致的观察,Coghill发现蝾螈最早的运动分为四个阶段:一是颈部向一侧的缓慢弯曲期,二是盘绕期,三是‘S’期,到最后的游泳。
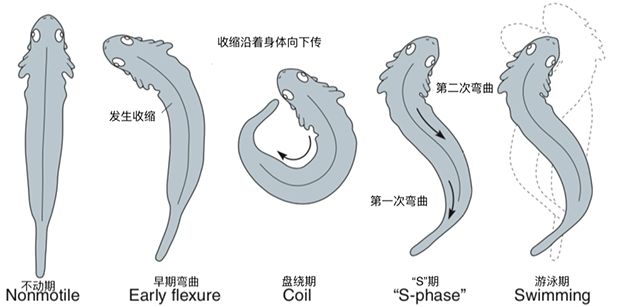
图说:蝾螈胚胎的行为发育过程。从简单的一侧弯曲到最终复杂的游泳行为,整个过程需要多种类型神经元的发育形成、简单环路的建立与整合[3]。
**这种游泳环路的建立依赖于感觉神经元与运动神经元,它们在预反射发生期支配了皮肤和肌肉。**在弯曲发生时,存在一类中间神经元,连接感觉神经元与运动神经元,使一侧的感觉通路传递给另一次的运动通路。这类神经元在弯曲期与盘绕期仅生成于脊髓与后脑的前部,所以来自皮肤的刺激信号向上穿越同侧的感觉通路,通过中间神经元跨越蝾螈颈部,刺激对侧的运动神经元,最终导致了蝾螈颈部的弯曲。信号继续沿着这一侧向下传导,使得脊髓后面相连的身体节段的运动神经元响应,蝾螈的整个身体于是就变成了盘绕状。随着发育的继续进行,这种沟通身体两侧的中间神经元逐渐生成并加入脊髓后端,蝾螈就能更轻松自如的响应刺激,控制自己的身体做出律动性的反应--游泳。
脑子不好使?去运动
随着个体的成长发育,运动行为也逐渐变得复杂多样,例如,唱歌、跳舞、打篮球。有些人进行不同种类的运动是出于兴趣,也有些人也是为了强身健体。除此之外,我们常常忽略的一点是运动对于脑健康的影响。
1978,Spirduso 和Clifford对年轻与年长的网球运动员、跑步选手与久坐者分别进行了决策、运动时间等简单任务测试[4]。结果表明,年长的职业运动员的表现优于年长的久坐者,但接近于年轻的久坐者。在他们之后,相继出现通过人类行为学调查与实验得出类似的结果:运动对年长的个体认知功能有改善作用[5]。
那么运动到底影响了哪个脑区呢?
这方面研究比较多的是运动对于海马体的影响。位于内侧颞叶的海马体由于其部位的弯曲形状类似海马而得名。海马体掌控着记忆和空间定位等认知功能,对运动与脑健康感兴趣的研究者们的目光也便聚焦于海马[6]。
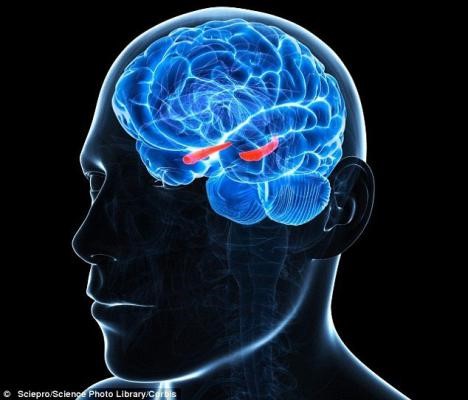

图片来源:wikipedia
脑来源的神经营养因子(Brain-derived neurotrophin factor, BDNF)支持了许多神经元的功能与存活,同时一些研究表明,脑中BDNF的产生受到神经活动的调控[7],那么物理运动能否增加BDNF的产生呢?产生的BDNF是否改善了脑环境呢?
1995年, Neeper等研究者让大鼠在夜晚进行跑轮实验,通过检测不同脑区BDNF 的mRNA表达水平,发现在海马体的锥体细胞中BDNF mRNA有明显的上调[8]。同时,研究者们还发现,BDNF mRNA水平与每晚的跑动距离有着强的正相关性。在检测运动组的12只大鼠中,有一只懒惰的大鼠没有跑,毫不意外,它的BDNF mRNA水平与对照组相当。
那么BDNF是如何改善脑环境的呢?
后续的一系列实验也发现了,BDNF对神经元的存活,神经发生,突触发生以及突触可塑性都发挥重要的功能[9]。但是运动引起哪个生化途径激活?进而诱导了BDNF的表达呢?2013年,Wrann等研究者发现耐力运动在小鼠海马体内引起了ERRα,PGC-1α, FNDC5和BDNF等基因的表达[10]。FNDC5是一种运动引起的肌肉蛋白,也是鸢尾素(Irisin)的前体蛋白。研究者发现,通过对小鼠静脉注射腺病毒,过表达或敲低FNDC5分别使BDNF的表达水平上调或下调。而BDNF处理过的原代海马神经元中FNDC5的表达却被抑制,这就揭示了一个FNDC5/BDNF反馈回路。
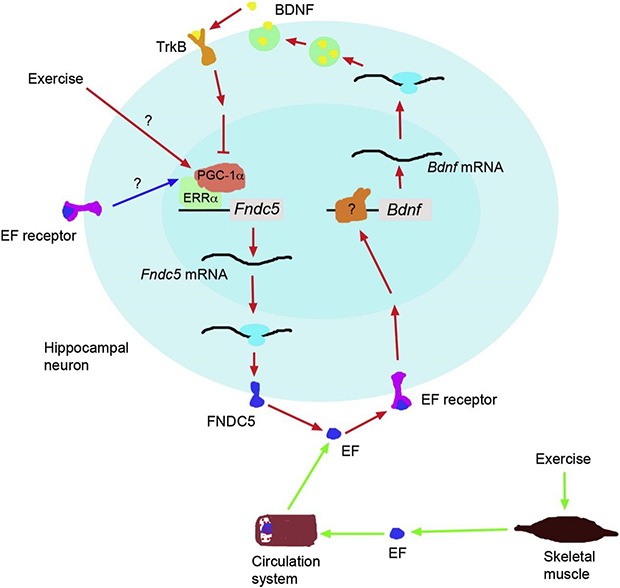
海马中调控运动引起的Bdnf基因表达的生化途径[11]。红色箭头的途径:运动以未知通路增加了海马神经元中PGC-1α的表达,增加的PGC-1α同时引起其结合伴侣ERRα的表达,继而增加FNDC5的表达;FNDC5作为I型膜蛋白,其水解产物运动因子(Exercise factor, EF)被释放到胞外基质;运动因子EF可能与其受体结合,以自分泌或旁分泌模式激活一种未鉴定的信号级联,引起Bdnf的表达。绿色箭头途径:运动因子EF同样在肌肉中产生并循环至全身。蓝色箭头途径:在循环系统中的运动因子EF可能激活海马神经元中PGC-1α的表达,进而增加FNDC5的表达,形成EF放大环路。
除了ERRα/PGC-1α → FNDC5 → BDNF 这条通路外,也有许多研究发现表明:BDNF还潜在地激活了mTOR通路,而mTOR通路对树突棘生成,轴突再生和突出传递起到重要作用[12]。最新的研究也表明:体育锻炼通过激活mTOR通路改善了学习记忆[13]。
除了持久运动以外,也有的研究者关注短时间剧烈运动对脑环境的影响,结果显示了短时程运动对突触功能的改善[14]。
运动,或许还是“良药”
令科学家痴迷于运动改善脑健康机制的一个重要原因就是,如果能够挖掘清楚其作用机制,那么运动对疾病脑环境的改善、对神经退行性疾病患者的预防、治疗与缓解就值得更深入的探索,基于此的临床疗法也值得开发。
海马体作为脑内学习记忆等认知功能的主管,在阿尔兹海默症和抑郁症患者中,这个组织也是受到严重影响的脑区之一。既然运动能改善正常小鼠中海马体神经元的生存环境,那么对于疾病脑环境是否有同样的作用呢?
2018年的《科学》杂志的一项研究报道[15],在AD转基因模型小鼠中,Choi等研究者通过慢病毒过表达Wnt3或者药物诱导海马体的神经元再生,同时慢病毒过表达BDNF模拟运动的作用,发现小鼠的认知功能有明显的改善。
同时,2019年的《自然医学》杂志的一项研究报道[16],通过训练β-淀粉样低聚物注射过的小鼠(模拟AD病理的小鼠模型),使其周期性游泳,发现与无运动训练组相比,日常游泳训练的小鼠在恐惧条件反射的行为学检测中表现更佳,突触可塑性也有所提高。
虽然有如此多的实验室证据表明了运动对脑环境的改善、突触功能的增强、认知行为的提高、神经退行性疾病的缓解都有极大的作用,但我们也要客观的认识到这些研究的局限性(小动物模型)和非普遍性(不同的行为学范式)。距离疾病的预防与治疗还要跨过一个又一个的基础到临床的“死亡谷“。
乐观的看,在药物开发不断受挫、陷入迷茫的时期,简单廉价的运动不失为一种好的辅助方法—不需要高大上的健身房,不需要每天拼命打卡10公里,不需要霸占朋友圈和微信运动Top5,踏踏实实的走上3000到9000步也许就够了[17]。
那么读完了本文的你,为何不放下手机,去运动一下呢?
参考文献:
[1] Pevsner J (2019) Leonardo da Vinci's studies of the brain. Lancet, 393(10179):1465–1472.
[2] vince, M. A. (1979). Effects of accelerating stimulation on different indices of development in Japanese quail embryos. Journal of Experimental Zoology, 208(2), 201–212.
[3] Sanes, D. H., Reh, T. A., & Harris, W. A. (2011). Development of the nervous system. Academic Press.
[4] Spirduso,W.W.,& Clifford,P. (1978). Replication of age and physical activityeffects on reaction time movement time. Journal of Gerontology,33,23-30.
[5] Colcombe, S., & Kramer, A. F. (2003). Fitness effects on the cognitive function of older adults: a meta-analytic study. Psychological science, 14(2), 125-130.
[6] https://en.wikipedia.org/wiki/Hippocampus
[7] Zafra, F., Castren, E., Thoenen, H., & Lindholm, D. (1991). Interplay between glutamate and gamma-aminobutyric acid transmitter systems in the physiological regulation of brain-derived neurotrophic factor and nerve growth factor synthesis in hippocampal neurons. Proceedings of the National Academy of Sciences, 88(22), 10037-10041.
[8] Neeper, S. A., Góauctemez-Pinilla, F., Choi, J., & Cotman, C. (1995). Exercise and brain neurotrophins. Nature, 373(6510), 109.
[9] Park, H., & Poo, M. M. (2013). Neurotrophin regulation of neural circuit development and function. Nature Reviews Neuroscience, 14(1), 7.
[10] Wrann, C. D., White, J. P., Salogiannnis, J., Laznik-Bogoslavski, D., Wu, J., Ma, D., ... & Spiegelman, B. M. (2013). Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway. Cell metabolism, 18(5), 649-659.
[11]Xu, B. (2013). BDNF (I) rising from exercise. Cell metabolism, 18(5), 612-614.
[12] Li, N., Lee, B., Liu, R. J., Banasr, M., Dwyer, J. M., Iwata, M., ... & Duman, R. S. (2010). mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science, 329(5994), 959-964.
[13] Chen, K., Zheng, Y., Wei, J. A., Ouyang, H., Huang, X., Zhang, F., ... & Zhang, L. (2019). Exercise training improves motor skill learning via selective activation of mTOR. Science advances, 5(7), eaaw1888.
[14] Chatzi, C., Zhang, Y., Hendricks, W. D., Chen, Y., Schnell, E., Goodman, R. H., & Westbrook, G. L. (2019). Exercise-induced enhancement of synaptic function triggered by the inverse BAR protein, Mtss1L. eLife, 8, e45920.
[15] Choi, S. H., Bylykbashi, E., Chatila, Z. K., Lee, S. W., Pulli, B., Clemenson, G. D., ... & Aronson, J. (2018). Combined adult neurogenesis and BDNF mimic exercise effects on cognition in an Alzheimer’s mouse model. Science, 361(6406), eaan8821.
[16] Lourenco, M. V., Frozza, R. L., de Freitas, G. B., Zhang, H., Kincheski, G. C., Ribeiro, F. C., ... & Berman, H. (2019). Exercise-linked FNDC5/irisin rescues synaptic plasticity and memory defects in Alzheimer’s models. Nature medicine, 25(1), 165.
[17] Rabin, J. S., Klein, H., Kirn, D. R., Schultz, A. P., Yang, H. S., Hampton, O., & Pruzin, J. Associations of Physical Activity and β-Amyloid With Longitudinal Cognition and Neurodegeneration in Clinically Normal Older Adults. JAMA Neurology.
Del Maestro, R. F. (1998). Leonardo da Vinci: the search for the soul. Journal of neurosurgery, 89(5), 874-887.




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国