北京时间10月1日17时30分许,瑞典卡罗琳斯卡医学院在斯德哥尔摩宣布,将2018年诺贝尔生理学或医学奖授予来自美国德克萨斯大学的詹姆斯•艾利森(James P Allison)和日本京都大学的本庶佑(Tasuku Honjo)两位免疫学专家,他们将共享900万瑞典克朗(约合人民币696万元)的奖金。而这次他们摘下诺奖的原因是“在抑制负向免疫调节机制的研究中发现了新癌症疗法(for their discovery of cancer therapy by inhibition of negative immune regulation.)。

图片来源:诺贝尔奖官网
为什么是他们摘下诺奖?
癌症每年导致数百万人死亡,是人类面临的最大健康挑战之一。今年的诺贝尔奖获得者在多年的研究下,建立了一个全新的癌症治疗方法:通过本来就有的免疫系统来抗击癌症。詹姆斯•艾利森所研究的是一种蛋白质(CTLA-4),他首次在动物模型上证明了这种蛋白质对于免疫系统具有强烈抑制作用。他意识到如果把这个“刹车片”进行抑制,将可能释放我们身体免疫细胞对癌细胞发起攻击的潜力。在此研究理论上,他发展出一套全新的癌症诊疗方案。2011年,美国FDA批准基于该机理的第一款癌症免疫药物伊匹单抗(ipilimumab,用于治疗黑色素瘤)上市。
与此同时,本庶佑在免疫T细胞表面发现了一种蛋白质(PD-1),在对其功能进行了细致研究之后发现,这种蛋白质同样对人体免疫系统具有抑制作用,也是一块免疫系统的“刹车片”,只是作用的机制有所不同。2014年,基于他的发现建立的癌症疗法PD-1抗体Pembrolizumab(派姆单抗,Keytruda)通过FDA批准上市,除了在黑色素瘤上的出色表现,其他实体瘤的治疗效果也表现不俗。
这两位科学家的研究,极大地推动了肿瘤与免疫领域的进步,并且促使癌症治疗新的药物面世。
我们的免疫防御能参与癌症治疗吗?
癌症包括许多不同的疾病,但共同的特征在于异常细胞不受控制的增殖并且具有扩散到健康器官和组织的能力。手术,放射治疗和化学治疗等是癌症的标准治疗方案,其中一些已被授予诺贝尔奖。包括用于前列腺癌的激素治疗法(Huggins,1966),化学疗法(Elion和Hitchins,1988)和用于治疗白血病的骨髓移植(Thomas 1990)。然而,对于晚期癌症至今仍然缺乏有效的治疗手段,因此迫切需要新的治疗策略。
图片来源:https://pixabay.com/zh/免疫系统-血液细胞-病毒-防御-辅助细胞-t-细胞-疾病-流感-1132182/
19世纪末,美国骨科医生William Coley意外的发现手术后感染酿脓链球菌病人的癌症出现了缓解,第一次打开了免疫疗法治疗癌症的大门。因此当时出现了这样的概念:即激活免疫系统或许可能是攻击肿瘤细胞的策略。有科学家尝试用细菌感染病人来激活免疫防御,但效果十分有限。人们逐渐意识到,我们对于自身的免疫系统抑制机制还缺乏足够了解。于是,很多科学家开始投身到与之相关的基础研究中,大量的研究工作慢慢勾勒出人体免疫系统的基本调节机制,并揭示了免疫系统识别癌细胞的原理。
免疫系统中的“刹车”分子
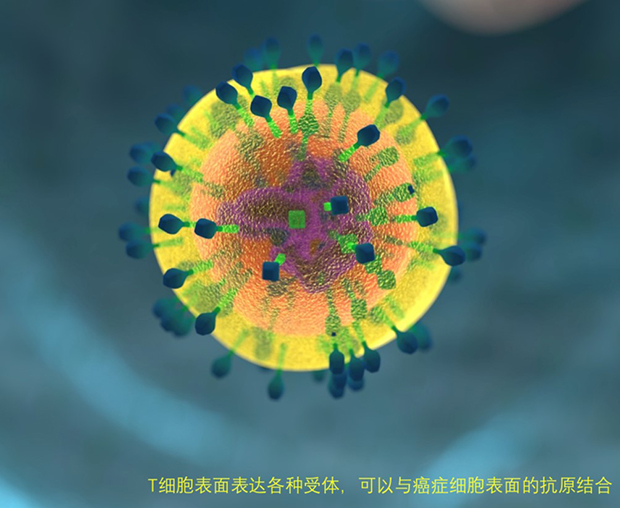
人体免疫系统的基本特性是区分“自我”和“非自我”,以便入侵的细菌、病毒和其他危险可以被识别和消除。白细胞之一的T细胞是这一防御的关键参与者。T细胞表面表达有与识别“非自我”的物质结合的受体,并且这种相互作用能够触发免疫监视来防御入侵者,类似“油门”与“刹车”。被称为“检查点阻断剂”的药物可以松开刹车踩油门,让T细胞与肿瘤作战。免疫监视能够识别、杀伤并及时清除体内突变细胞,防止肿瘤发生。人体免疫系统中主要的“抗癌战士”称为“T细胞”,其表面有不同功能的受体,PD-1是其中的关键,作为一种细胞膜蛋白受体,正常情况下其功能是抑制T细胞的激活,这是免疫系统的一种正常的自稳机制。
许多科学家为这项重要的基础研究作出了贡献,并确认了其他抑制免疫激活的蛋白质,这些蛋白同样对T细胞激活起抑制作用。“油门”和“刹车”之间的复杂平衡是健康状态的必要条件。它能确保免疫系统参与对外来微生物的攻击,同时避免可能导致健康细胞和组织的自身免疫破坏的过度激活(过敏)。但狡猾的癌细胞会产生一些伪装,比如癌细胞表面会分泌一些糖蛋白或者黏多糖,作为“刹车”阻碍T细胞激活,躲过免疫系统的监视,最后不受控制的增殖。更糟糕的是不同种类的癌细胞被识别出来的难易程度不同。
免疫治疗为什么是癌症治疗新篇章?
简单来说,免疫治疗能够为癌症标准治疗无效的晚期患者提供新的治疗方案,并且部分的患者效果十分良好。免疫药物的作用对象不是直接的癌细胞,而是免疫细胞。这类药物通过激活针对癌细胞的免疫系统,然后让大量活跃的免疫细胞成为真正的抗癌武器,完成使命。目前上市的PD-1抑制剂、PD-L1抑制剂和CTLA4抑制剂都是如此。
响应免疫疗法的患者,有很大机会高质量长期存活。在黑色素瘤,晚期非小细胞肺癌,肾癌,儿童急淋白血病等患者中,免疫疗法都制造出了一批“超级幸存者”,将被判死刑的晚期癌症患者从死亡线拉回,一旦药物治疗产生效果,能够实现较长时间不复发、不进展、且有机会实现长期带瘤生存。
绕不开的魏则西事件:免疫治疗还有很多待解决的问题
魏则西事件把免疫治疗以负面方式推向大众视野,让免疫治疗的一系列乱象被置于舆论的聚光灯下:过分夸大的疗效、未经批准的临床治疗、胡乱收取的高昂费用。由于目前缺乏具体监管措施在免疫细胞治疗领域,有一些机构在缺少大规模、正规的临床试验的情况下,直接就开始收费、推广未经批准的临床治疗。
目前主要的免疫治疗有几种方法。首先是对 T 细胞免疫检查点的调控,如用抗体阻断 CTLA-4 以及 PD-1 通路,其具有广谱效应可以治疗多种癌症。第二种疗法是 CAR-T 细胞免疫治疗,CAR-T 治疗最成功的例子是对血液肿瘤方面的治疗。第三种是体外激活(Tumor-infiltrating Lymphocytes , TIL),该方法主要是从肿瘤患者的肿瘤组织中提取出肿瘤环境中被抑制的免疫细胞,将其在体外进行培养,从而能够将其重新激活,然后再回输回患者体内,这种方法对肿瘤患者有一些治疗效果,但是还处于临床研究阶段。
即使目前上市的PD-1抑制剂、PD-L1抑制剂和CTLA4抑制剂,也并非完美的药物,因为作用的是人体免疫系统,需要等待产生作用的时间较长,并且对于晚期癌症患者来说身体能否承受副作用也是一个问题。
写在最后的话
笔者在去年的诺奖拾遗文章里就已经大胆预测过,PD-1/PD-L1应该是未来诺奖得主,今年获奖一点也不突兀,只是感叹这次的获奖名单里,是否少了一位华人科学家的身影?当然,每一个科研成果,都是无数科研工作者辛苦的工作所累积出来的。一个成熟的理论,一个诺贝尔奖级别的研究,从无到有,是需要许许多多论文来一点点论证探讨的,这些在舞台背后的科研工作者,最后谁能站到前台,享受鲜花荣誉和掌声,还是依然交给神秘的诺贝尔奖评审们来商量思考吧。
参考文献:
https://www.nobelprize.org/prizes/medicine/2018/press-release/
Leach, D. R., Krummel, M. F., & Allison, J. P. (1996). Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271(5256), 1734–1736.
(本文中标明来源的图片均已获得授权)




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国