导读:HIV疫苗研究之所以困难,是因为最适合用作HIV疫苗的病毒蛋白质十分脆弱,非常容易分解。令人遗憾的是,这些破碎的蛋白质本身不会诱导免疫系统产生保护性抗体,因此不能阻止HIV进入人体细胞。经过近20年的研究,科学家合成了一种人工蛋白质,不但不会分解,还能很好地模拟HIV的蛋白质,足以在动物试验中诱导机体产生所需抗体。
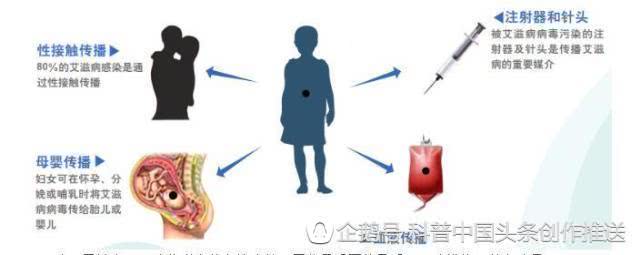
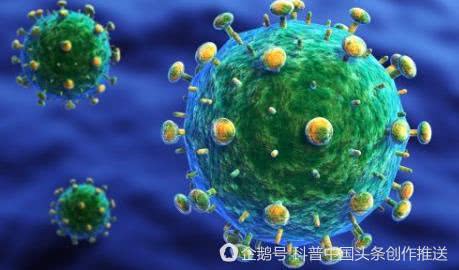
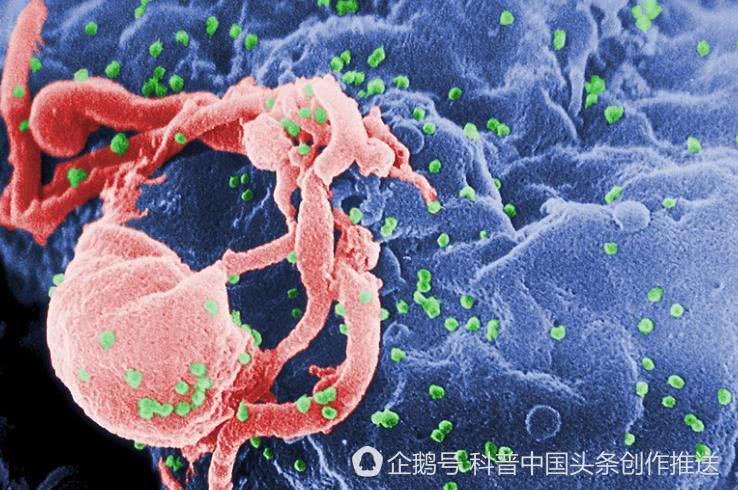
导读:HIV疫苗研究之所以困难,是因为最适合用作HIV疫苗的病毒蛋白质十分脆弱,非常容易分解。令人遗憾的是,这些破碎的蛋白质本身不会诱导免疫系统产生保护性抗体,因此不能阻止HIV进入人体细胞。经过近20年的研究,科学家合成了一种人工蛋白质,不但不会分解,还能很好地模拟HIV的蛋白质,足以在动物试验中诱导机体产生所需抗体。




