简介
核移植,是将供体细胞核移入除去核的卵母细胞中,使后者不经过精子穿透等有性过程即无性繁殖即可被激活、分裂并发育成新个体,使得核供体的基因得到完全复制的技术。以供体核的来源不同可分为胚细胞核移植与体细胞核移植两种。
通过显微操作,将细胞核移入去核卵母细胞中,培育发育成重组胚胎的技术。细胞核具有全能性,将核移植到去核卵母细胞中,可以发育成正常后代,并表现为供核个体的遗传特性。1
类型1、胚胎细胞核移植
胚胎细胞核移植是用显微手术的方法分离出着床的早期胚胎细胞,将其单个细胞导入去除染色体的未受精的成熟的卵母细胞中,经过电融合,让该卵母细胞质和导入的胚胎细胞核融合、分裂、发育为胚胎。把该胚胎移植给受体,让其妊娠、产仔。如今,已经成功地通过胚胎细胞核移植,产生的动物有小鼠、兔、山羊、绵羊、猪、牛和猴子等。
2、胚胎干细胞核移植
将胚胎或胎儿原始生殖细胞经过抑制分化培养,让其细胞数成倍增多,但细胞不分化,每个细胞仍具有发育成一个完整个体的能力。把该单个细胞利用以上核移植技术,将其导入除去染色体的成熟的卵母细胞内克隆胚胎,经移植至受体,并妊娠、产仔。
3、体细胞核移植
把动物体细胞经过抑制培养,使细胞处于休眠状态。采用以上核移植的方法,将其导入去除染色体的成熟的卵母细胞内,克隆胚胎,经植入受体,妊娠、产仔,克隆出动物。比如克隆绵羊“多利”。它是从一只成年母绵羊的乳腺中取出一个本身并没有繁殖功能的普通细胞,将这个细胞的基因分离出来备用;然后,再取出另一只母绵羊的未受精的卵细胞,将这个卵细胞的基因取出,换上第一只母绵羊乳腺细胞的基因,再将这个基因已被“调包”的卵细胞放电激活,使其开始像正常的受精卵那样进行细胞分裂;当细胞分裂进行至一定的阶段、胚胎已经形成后,再将这个胚胎移植到第三只母绵羊子宫内,经过正常的妊娠后产下“多利”。2
具体方法哺乳动物核移植技术研究进展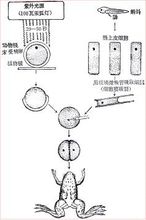 哺乳动物核移植是将外源的一个细胞核与一个去核卵母细胞结合,产生遗传上同质的动物的技术。它在动物育种、制备转基因动物、基因治疗及器官移植等方面具有重大的作用。
哺乳动物核移植是将外源的一个细胞核与一个去核卵母细胞结合,产生遗传上同质的动物的技术。它在动物育种、制备转基因动物、基因治疗及器官移植等方面具有重大的作用。
1、供体核的获得
供体核可以是早期胚胎细胞、胚胎千细胞和体细胞。早期都采用合子核到64细胞期的胚胎细胞核质体分裂球作供体细胞核,80年代开始,随着胚胎干细胞(embryo stem cells,ES)的建立和对其研究的深入,人们对胚胎干细胞在核移植方面的应用前景寄予厚望,但ES建系太困难,仅在小鼠上获得成功。Teruhiko Wakayama等利用ES系克隆小鼠,结果有29%的重构胚在体外能发育到囊胚阶段,移植给假孕小鼠有8%胚胎附植并产下小鼠。1997年Dolly羊的出现,开始了体细胞的核移植,并发展很快。
(1)胚细胞
用0.2%链霉蛋白酶预处理胚胎,溶去胚胎的胶膜及透明带,分离出单个卵裂球。消化透明带的时间是影响卵裂球质量的重要因素,作用时间短,透明带不能充分消化,卵裂球不易获得;作用时间长,则影响到卵质膜,容易破裂,在操作时容易失败。因此,在分离卵裂球时应在解剖镜下监视透明带的消化过程,当透明带变薄,膨胀适度时就应移出,再用适当口径的吸管吹打使之分离。另外,苏格兰学者Campbell等显微分离胚盘细胞并在体外进行缺血饥饿传代培养,诱使细胞处于“静止”状态,以便调整染色体结构,从而有助于核的重组与发育,他们使用这种方法建立了绵羊TNT4细胞系,该细胞形态类似于胚胎干细胞,但更扁平、上皮化。
(2)体细胞
最早用青蛙肠粘膜上皮细胞获得了后代。Wilmut等用绵羊乳腺细胞获得Dolly羊。美国夏威夷大学Ryuzo Yanagimachi教授领导的一个国际科研小组于1998年以小鼠卵丘细胞为核供体,采用吸移管注入,利用机械和化学激活方式进行细胞的融合,成功培育三代克隆小鼠。对小鼠、牛体细胞移植的相关研究中发现休眠(G0)的颗粒细胞核与去核MⅡ期卵母细胞构成的体细胞重构胚,其发育率及产生克隆后代的能力远高于其它类型的休眠体细胞,这可能缘于颗粒细胞上存在着与卵母细胞紧密联系的胞质微绒毛桥的缘故,它或许有助于供体核同受体核胞质因子的交换。
2、受体细胞去核
作为细胞核移植的受体细胞主要有三类:去核的卵母细胞、受精卵和2-细胞胚胎,其中卵母细胞应用最为广泛。有人用两个去核卵母细胞融合后产生的胞质作为受体进行各代核移植,以增核移植胚胎的细胞数和提高继代移植效率。研究证明,体外成熟培养的卵母细胞核移植成功率不如体内成熟的卵母细胞,其原因可能是卵母细胞在体外成熟过程中,需要合成一些蛋白质来完成第一次减数分裂,体外成熟的一些卵母细胞其活动有可能受到抑制。
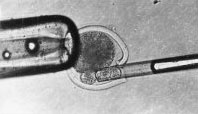 (1)盲吸法
(1)盲吸法
用微细玻璃管在第一极体下盲吸,吸除第一极体及处于分裂中期的染色体和周围的部分细胞质,但该方法成功率低。为提高去核率,利用Hoechst33342染料对染色质的特异性染色作用,在荧光显微镜下去核后判断去核是否完成,去核准确率大为提高。Stice等用Hoechst33342(1μg/ml)染色,在紫外线下照射的时间控制在10s以内,未观察到对胚胎发育的负面影响。
(2)半卵法
用微细玻管针在透明带上做一切口后,用微细玻管吸去一半染色质至另一半空透明带内,即将卵母细胞分为两半,然后用Hoechst33342染色,确定不含染色体的一半为细胞质受体。其操作方法如下,将卵母细胞移入35mm含有mPBSA(磷酸缓冲液,其中有D-葡萄糖1000mg/l、丙酮酸36mg/l、0.4%牛血清白蛋白、1%青霉素和链霉素10000μg/ml)的皮氏培养皿中进行显微操作,首先分两步进行分割透明带,即先在透明带上切一小口,然后用另一切割针扩大切口,从而分割透明带。透明带被切除后转移到含有mPBSA+5μg/ml细胞松弛素B的35mm的皮氏培养皿中作用3一5min,然后用固定针(内径为透明带的l/5一1/3,外径接近透明带的直径)固定,分割针进入透明带的隙口中并将该针固定在靠着透明带的地方,缓慢吸取卵母细胞液,当分割针中吸取了一半卵母细胞液时,这时将该针从卵黄隙中移出,并靠着透明带切割边缘轻微地擦过以达到完全的分割,将其针中的卵母细胞液移入准备好了的空透明带中,并用Hoechst33342染色,荧光显微镜下观察不发荧光的作为受体卵母细胞。
(3)离心去核
Tatham等以15000g、2min离心牛卵母细胞,用链霉蛋白酶去除卵母细胞透明带(ZP),经渗透压梯度离心,MⅡ期纺锤体可从大多数卵母细胞中分开,把无透明带的去核胞质作核移植的供质,同分裂球聚集经电融合成核移植胚,最后放入藻酸钠假透明带中,能在体外卵裂和发育,但其效果还有待于进一步研究。
(4)末Ⅱ期去核法
Bordignon等提出把卵母细胞先激活使之处于末Ⅱ期,在排出第二极体时吸出第二极体及周围的少量细胞质,从而达到去核。这种方法避免使用DNA染料和经紫外线照射来定位染色体,并且去除的细胞质相对较少。该去核方法比MⅡ期去核的成功率有显著提高,但这种细胞质容易老化,是否能对基因组完全重排序,顺利完成后期发育,有待于研究。
多数研究者在多数卵母细胞出现第一极体的成熟时期去核,去核时间,体内成熟在发情开始后48h,体外成熟22-24h。卵母细胞去核程序与重构胚中再程序化状况密切相关,去核率越高,其克隆胚最终发育成正常胚的可能性越大。去核率的高低与卵母细胞所处的成熟时期以及所采用的方法密切相关。以前的核移植研究均采用未激活的卵母细胞作为核受体,并认为激活后卵母细胞的重排能力会下降,影响核移植的效率。但Ushijima,等和Terlovw等;研究表明,激活后的卵母细胞作为核供体时,重构胚融合和发育能力均优于融合激活同时进行的效果。
3、核卵重组
在显微操作仪操纵下,用一直径接近卵裂球大的移植针吸取一枚分离出的完整卵裂球,注入去核的受体卵母细胞的间隙中,根据移人的部位不同,可分为带下移植和细胞质内注射。那些卵裂球很难分离的胚胎可以在添有钙和镁-游离的磷酸缓冲盐溶液的mPBSA中孵育30-60min使细胞分裂停止。但孵育时间超过60min,细胞膜的完整性将遭到破坏,操作过程中细胞的溶化率将增加。在移植针移开后,对移植卵裂球上方的透明带施加压力使卵裂球与半卵母细胞接触。
4、细胞融合与激活
由于微吸管破坏了卵膜和一部分细胞质,若直接移植,成功率很低,故需对重组胚融合,其采用的方法有仙台病毒法、物理或化学方法(如电融合法、钙离子载体、乙醇、蛋白质酶合成抑制剂等)激活受体细胞,使其完成细胞分裂和发育过程,电融合法更常用。电融合时选择的电压范围和脉冲频率取决于融合箱中两个电极的距离。融合箱的距离由200μm,到几毫米,因此在脉冲是200μsec倍数且能传导lKV/cm的直流电基本满足要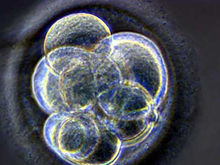 求。对小鼠、家兔等实验动物进行胚胎核移植时还发现,受体卵母细胞在重构胚电融合时被激活的状态与重购胚的发育率密切相关,脉冲强度为2.0-3.6K/cm、融合时间为60-200μsec是适宜范围。若脉冲过强,融合时间过长,对重构胚的进一步发育极为不利。Kono等提出针对不同时期的供体核采取不同激活程序得到了较好的实验结果:①对于G2期和M期的供体核即4倍DNA供体,在融合时可采用不引起卵母细胞活化的仙台病毒或细胞质内注射,然后再给予激活处理,使一半DNA以极体方式排出,随后形成原核及正常2倍体细胞,应用此法已产生了正常的小鼠;②对于G0、G1及S期供体核,可采用融合前激活和融合时激活两种方式,以防止供体核形成中期板而导致染色体的不正常。Szollosi用小鼠胸腺细胞作核移植实验时发现,只有成熟的去核卵母细胞被激活前或激活后30min进行融合,移入的供体细胞核才发生降解,并重新聚合形成新核膜,若超过30min再触合,虽然移入的供体核才发生降解,这可能会使供体染色质与受体细胞质诸因子的有效互作受到抑制,从而使再程序化过程受阻。Wakayama等人利用受体卵母细胞化学激活和重构胚化学融合的方法,也在小鼠体细胞克隆和再克隆的研究中取得了理想的结果。
求。对小鼠、家兔等实验动物进行胚胎核移植时还发现,受体卵母细胞在重构胚电融合时被激活的状态与重购胚的发育率密切相关,脉冲强度为2.0-3.6K/cm、融合时间为60-200μsec是适宜范围。若脉冲过强,融合时间过长,对重构胚的进一步发育极为不利。Kono等提出针对不同时期的供体核采取不同激活程序得到了较好的实验结果:①对于G2期和M期的供体核即4倍DNA供体,在融合时可采用不引起卵母细胞活化的仙台病毒或细胞质内注射,然后再给予激活处理,使一半DNA以极体方式排出,随后形成原核及正常2倍体细胞,应用此法已产生了正常的小鼠;②对于G0、G1及S期供体核,可采用融合前激活和融合时激活两种方式,以防止供体核形成中期板而导致染色体的不正常。Szollosi用小鼠胸腺细胞作核移植实验时发现,只有成熟的去核卵母细胞被激活前或激活后30min进行融合,移入的供体细胞核才发生降解,并重新聚合形成新核膜,若超过30min再触合,虽然移入的供体核才发生降解,这可能会使供体染色质与受体细胞质诸因子的有效互作受到抑制,从而使再程序化过程受阻。Wakayama等人利用受体卵母细胞化学激活和重构胚化学融合的方法,也在小鼠体细胞克隆和再克隆的研究中取得了理想的结果。
对兔卵电融合完成后,卵母细胞也因电刺激受到激活从而开始新的编程和发育,但对小鼠、大鼠和牛等还需进一步充分的激活才能获得发育。其方法有化学和电激活两种,化学激剂有7%乙醇、Ionomycin(离子霉素)、钙离子载体A23187,采用Ionomycin激活后再用6-DMAP处理3h,可避免出现PCC(早熟染色体凝集),并增加羊重构胚的发育率及出生率。
5、重构胚培养与移植
 重构胚需一定时间的培养,方可移植到受体,家兔和猪重构胚在体外培养24h以内,就可通过非手术移植,而羊和牛重构胚所需培养时间较长,一般发育到囊胚或桑堪胚时移植。培养的方法是可将电融合的重构胚放大10%FCS的RD微滴内培养,也可将显微操作的胚胎移入同种或异种的输卵管中进行培养,几天后冲洗输卵管,回收重构胚。后者的实验方法如下,先用琼脂和0.9%NaCI制成1.0%和1.2%琼脂糖,将1.0%的琼脂倒入35mm的皮氏培养皿中,当温度为37℃时将胚胎移入琼脂块中。应用琼脂切割针吸取一气泡和mPBSA+20%新生犊牛血清,然后吸取含有琼脂的胚胎,该针在室温下保持几秒钟后将其放入MPBSA+20%新生犊牛血清的皮氏培养皿中。当1.2%的琼脂温度达到37℃时,采用同上的方法在琼脂糖中洗涤几次,然后组成双层琼脂并采用手术移植到输卵管中。在体外进行重构胚的培养时,选择适当的培养液非常重要。重构胚的移植与胚胎移植的方法基本一样,即根据受体动物的不同可分为手术移植和非手术移植。3
重构胚需一定时间的培养,方可移植到受体,家兔和猪重构胚在体外培养24h以内,就可通过非手术移植,而羊和牛重构胚所需培养时间较长,一般发育到囊胚或桑堪胚时移植。培养的方法是可将电融合的重构胚放大10%FCS的RD微滴内培养,也可将显微操作的胚胎移入同种或异种的输卵管中进行培养,几天后冲洗输卵管,回收重构胚。后者的实验方法如下,先用琼脂和0.9%NaCI制成1.0%和1.2%琼脂糖,将1.0%的琼脂倒入35mm的皮氏培养皿中,当温度为37℃时将胚胎移入琼脂块中。应用琼脂切割针吸取一气泡和mPBSA+20%新生犊牛血清,然后吸取含有琼脂的胚胎,该针在室温下保持几秒钟后将其放入MPBSA+20%新生犊牛血清的皮氏培养皿中。当1.2%的琼脂温度达到37℃时,采用同上的方法在琼脂糖中洗涤几次,然后组成双层琼脂并采用手术移植到输卵管中。在体外进行重构胚的培养时,选择适当的培养液非常重要。重构胚的移植与胚胎移植的方法基本一样,即根据受体动物的不同可分为手术移植和非手术移植。3
应用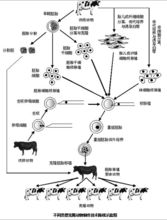 1、细胞治疗
1、细胞治疗
细胞移植可以治疗由于细胞功能缺陷所引起的各种疾病,如糖尿病;中枢神经系统疾病(帕金森,阿尔莫茨症);肝功能衰竭;甲状腺疾病。
2、异种器官移植
治疗性克隆是利用核移植技术将病人的体细胞核移植到去核的卵母细胞中,使其重编程并发育成囊胚,然后再用胚胎干细胞分离技术从克隆囊胚的ICM分离出多能胚胎干细胞(ES)。这种干细胞在遗传学上和病人完全一致,再定向诱导其分化成病人所需要的体细胞进行移植,以取代和修复患者已丧失功能的细胞、组织或器官,而达到完全治愈。治疗性克隆不仅解决移植物与受者间的免疫排斥反应问题,而且可以解决移植物的来源问题。
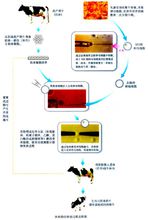
3、核移植科普图
 1997年底,英国Roslin研究所和PPL公司通过克隆转基因体细胞,获得了6只整合neo或neo和F2IX基因绵羊,这标志着核移植介导的转基因技术成功问世。2000年,英国PPL公司将人AAT基因定点整合到胎儿成纤维细胞的α1原胶原(Procollagen)基因座位,而后用转基因细胞进行核移植,生产出世界首例基因打靶绵羊,其乳中AAT蛋白含量达到了650mg/L,远高显微注射法18mg/L的水平。2004年,台湾培育带有治疗血友病的“第八凝血因子”的体细胞克隆羊。2005年,这只克隆羊产下一只同样带有第八凝血因子的公羊。虽然核移植技术有着广阔的应用前景,并且已取得了一些进展如体细胞核移植等,但也存在着一些问题。主要包括核移植效率低,动物畸形。这要求研究人员进一步了解核质作用机理,改进培养方式。
1997年底,英国Roslin研究所和PPL公司通过克隆转基因体细胞,获得了6只整合neo或neo和F2IX基因绵羊,这标志着核移植介导的转基因技术成功问世。2000年,英国PPL公司将人AAT基因定点整合到胎儿成纤维细胞的α1原胶原(Procollagen)基因座位,而后用转基因细胞进行核移植,生产出世界首例基因打靶绵羊,其乳中AAT蛋白含量达到了650mg/L,远高显微注射法18mg/L的水平。2004年,台湾培育带有治疗血友病的“第八凝血因子”的体细胞克隆羊。2005年,这只克隆羊产下一只同样带有第八凝血因子的公羊。虽然核移植技术有着广阔的应用前景,并且已取得了一些进展如体细胞核移植等,但也存在着一些问题。主要包括核移植效率低,动物畸形。这要求研究人员进一步了解核质作用机理,改进培养方式。
到2007年为止,虽然核移植技术的发展较快,然而该技术还存在许多问题,如核移植成功率普遍比较低、重构胚的发育率低、畸形胚的比率高。体外培养的时间过长或培养液的成份可能导致移植胚的流产以及出生后的仔畜很快死亡。基因重组编程的机制尚不清楚,其中MPF、NEBD(核膜破裂)和PCC在基因组重编过程的作用还需阐明。基因印记对核移植重新编程的影响以及基因印记与动物克隆技术的成功及不足有何关系,还不清楚。
2001年我国科学家将牛耳细胞克隆的胚胎移入135头牛体内,每头牛移植了两枚克隆胚胎。从2002年1月8日起,陆续获取了14头克隆牛犊。至2003年11月,这批被克隆的牛,存活的只有5头。
体细胞核移植技术在畜牧业、医药卫生,以及其它领域拥有着广泛的应用前景。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国