b型流感嗜血杆菌结合疫苗,适应症为预防由b型流感嗜血杆菌引起的侵袭性疾病。
成份与性状活性成份
每0.5毫升疫苗所含活性成份为7.5微克b型流感嗜血杆菌荚膜多糖和125微克脑膜炎球菌外膜蛋白(载体蛋白)的偶联结合物。
辅料
每0.5毫升疫苗含有225微克稀释剂羟基磷酸铝硫酸盐和0.9%生理盐水。
性状本品为轻微混浊的白色溶液。
接种对象-预防用生物制剂本品适用于2-71月龄婴幼儿免疫接种,预防由b型流感嗜血杆菌引起的侵袭性疾病。
作用与用途-预防用生物制剂用于b型流感嗜血杆菌引起的侵袭性疾病的预防。
规格0.5mL/瓶
每0.5mL疫苗所含活性成份为7.5微克b型流感嗜血杆菌荚膜多糖和125微克B群脑膜炎球菌外膜蛋白(载体蛋白)的偶联结合物。
免疫程序和剂量**[u]供肌肉注射使用[/u]**
[u]勿静脉注射[/u]
2-14月龄
2-14月龄的婴儿最好在2月龄时接种第一针疫苗(0.5mL),间隔两个月后(或此后尽早)接种第二针疫苗(0.5mL)。若在12月龄之前已完成两针基础免疫接种,还须加强免疫接种一针(见下文)。
15月龄
15月或超过15月龄的幼儿只须接种一针本品。
加强免疫接种
在12月龄前已完成两针基础免疫接种的婴幼儿,应在12-15月龄期间再加强免疫接种一针本品(0.5mL),加强免疫与基础免疫第二针之间的间隔不得少于2个月。
非口服(肠道外用)制剂在使用前应肉眼检查有无异物颗粒和变色。本品含有稀释剂羟基磷酸铝硫酸盐,为轻微混浊的白色溶液。
接种时要特别小心,务必不要将本品注射到血管内。
每个接种对象应分别使用不同的无菌注射器和针头,以防接种对象之间相互传染乙型肝炎或其它传染性疾病。
本品即开即用,不需要溶解或稀释。
疫苗在使用前应充分摇匀,以维持疫苗的混悬状态。
经肌肉注射0.5mL,首选接种部位为大腿前外侧或上臂外侧。
不良反应在一项比较本品和冻干剂型b型流感嗜血杆菌疫苗疗效的多中心临床研究中(n=903),678例2-6月龄健康的普通美国婴幼儿接种了1699针本品。其中大多数接种者还同时接种了DPT(白百破三联疫苗)和OPV(口服脊髓灰质炎疫苗)。接种者对两种不同剂型的b型流感嗜血杆菌疫苗耐受性良好,未发现与疫苗相关的严重不良反应。
在初次接种本品后的三天内,最常出现的不良反应(发生率>1%,不考虑发生的原因,除表1所列之外)按照发生率递减顺序排列有:烦躁、嗜睡、接种部位疼痛、接种部位红斑(直径≤2.5cm,见表1)、接种部位肿块/硬结(直径≤2.5cm,见表1)、异常高声哭闹、哭闹时间过长(>4小时)、腹泻、呕吐、哭闹、疼痛、中耳炎、皮疹和上呼吸道感染。
婴幼儿初次接种本品后,由家长观察48小时以上,所报告的经选择的客观观察指标列于表1。
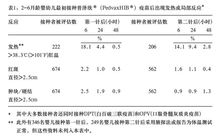
加强免疫接种后3天内,所观察到的不良反应类型和发生率与初次接种后类似。
上市后的经验
如同任何疫苗一样,临床广泛使用本品后,可能会发现一些在临床研究中并未发现的不良反应。下述是已经被报告过的不良反应:
血液和淋巴系统
淋巴结病
过敏症
罕见的血管神经性水肿
神经系统
惊厥(包括发热惊厥)
皮肤
无菌注射部位的溃疡;注射部位的疼痛。
禁忌对本品任何成份过敏者。
注意事项恶性肿瘤患者、正在接受免疫抑制治疗的患者或存在其它免疫功能缺陷者,若接种本品,可能无法获得应有的免疫保护效果。
接种本品后若出现过敏反应,应迅速采取有效的治疗措施,必要时可使用肾上腺素等药物进行急救。
与其它疫苗一样,接种本品后可能不会立即诱导机体产生达到保护作用水平的抗体。
与其它疫苗一样,接种本品后,并不是100%的接种对象都能产生具有保护性的抗体反应。
与b型流感嗜血杆菌多糖疫苗及另一种b型流感嗜血杆菌偶联疫苗所报道的情况类似,接种本品一周内,在诱导机体产生针对细菌的保护性效应前,仍可能出现b型流感嗜血杆菌引起的疾病。
尚无充分证据表明自然接触b型流感嗜血杆菌后迅速接种本品是否能阻止发病。
任何急性感染或发热性疾病期间,应暂缓接种本品,除非医生认为不接种疫苗会导致更严重的危险。
接种本品后,会产生针对载体蛋白(脑膜炎球菌)的免疫原性应答,但此反应的临床意义尚不清楚。
孕妇及哺乳期妇女用药尚未进行本品的动物生殖毒性试验。不建议6岁及6岁以上个体接种本品。
儿童用药尚未在不足2月龄婴儿和6岁及6岁以上儿童中进行本品的安全性和有效性试验。
药物相互作用正在接受免疫抑制治疗的患者接种本品后,可能无法获得应有的免疫反应。
与其它疫苗同时使用
临床研究证明,本品与初次免疫和/或加强免疫的DPT(白百破三联疫苗)和OPV(口服脊髓灰质炎疫苗)同时接种,或与M-M-R II(麻疹、腮腺炎、风疹三联活疫 苗,MSD)同时接种(采用不同的注射部位及不同注射器),对所测试的各单一抗原产生的免疫反应不会产生影响和损害。在这些疫苗同时使用的研究中,所观察到的不良反应类型、发生率及反应轻重程度与上述疫苗单独使用相类似。
实验室相互作用试验
敏感试验,如乳液凝集盒,对一些接种Hib偶联疫苗30天后的接种者,其尿中来自原疫苗的PRP(流感嗜血杆菌多糖)可以检测出。
药物过量尚无这方面的资料。
药理毒理本品是一种多糖蛋白偶联疫苗,能诱导机体产生抗b型流感嗜血杆菌荚膜多糖的抗体。
贮藏须在2-8℃贮藏,请勿冰冻。
包装1瓶/盒,10瓶/盒
有效期36个月
执行标准进口药品注册标准JS200000661




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国