他克莫司胶囊,适应症为预防肝脏或肾脏移植术后的移植物排斥反应。治疗肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。
警示语由于免疫抑制,发生淋巴瘤和其他恶性肿瘤,尤其是皮肤癌的风险增加;对细菌、病毒、真菌和原虫感染包括机会感染在内的易感性增加.本品应由有免疫抑制治疗和器官移植病人管理经验的医师处方。服用本品的患者应由配备足够实验室设备和医护人员的医疗机构进行随访。负责维持治疗的医师应掌握进行随访所需的全部信息。
成份本品主要成份为他克莫司,化学名称为:[3S-[3R[E(1S,3S,4S)], 4S,5R,8S,9E, 12R,14R,15S,16R,18S,19S,26aR]]-5,6,8,11,12,13,14,15,16,17,18,19,24,25,26a-六-癸氢-5,19-二羟基-3-[2-(4-羟-3-甲氧环己基)-1-甲基乙烯基]-14,16-二甲氧-4,10,12,18-四甲基-8-(2-丙烯基)-15,19-环氧-3H-吡啶并[2,1-c][1,4] 氧杂氮杂环二十三碳烯-1,7,20,21(4H,23H)-四酮,一水合物。化学结构式:
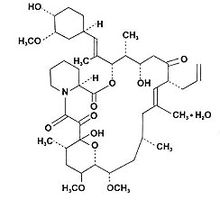
分子式:C44H69NO12·H2O
分子量:822.03
性状0.5mg:浅黄色硬质胶囊,内容物为白色粉末。
1mg:白色硬质胶囊,内容物为白色粉末。
5mg:灰红色硬质胶囊,内容物为白色粉末。
适应症预防肝脏或肾脏移植术后的移植物排斥反应。治疗肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。
规格0.5mg;1mg;5mg。
用法用量本品的治疗需要在配备有充足实验设备和人员的条件下密切监测。只有在免疫抑制治疗和移植患者管理方面有经验的医师才可处方本品和改变免疫抑制治疗方案。
不慎、无意或在无监督下的他克莫司胶囊和他克莫司缓释胶囊之间的转换是不安全的。这可能导致移植物排斥或增加不良反应发生.包括由于他克莫司全身暴露的临床相关差异而导致的免疫抑制不足或过度。患者应维持他克莫司单一剂型及相应的日给药方案进行治疗。改变剂型或调整剂量只能在移植专家严密的监督下进行。任何剂型转换后,都需要监测治疗药物,并调整剂量以保证他克莫司的全身暴露前后一致。
以下推荐起始剂量仅作一般指导。普乐可复给药剂量主要基于对个体患者排斥反应和耐受性的临床评价辅以血药浓度监测(参见以下推荐目标全血谷浓度)。如果排斥反应临床症状明显,则应考虑改变免疫抑制治疗方案。
普乐可复可通过静脉或口服给药。通常先口服给药,必要时将胶囊内容物悬浮于水中,鼻饲给药。(一些移植研究机构报告了鼻饲给药。)
在术后早期,普乐可复通常与其他免疫抑制剂联合应用,剂量依所选免疫抑制方案的不同而改变。
给药方法
推荐每日服药两次(如早晨和晚上)。胶囊从泡罩中取出后应立即用液体送服(最好用水)。切勿吞服干燥剂。
建议空腹或餐前1小时或餐后2~3小时服用胶囊。以使药物最大吸收。
他克莫司与PVC不相容。用于本品内容物混悬液制备和给药的导管、注射器和其他设备不能含有PVC。
给药时限
为抑制移植物排斥、患者需长期服用免疫抑制剂,因此本品口服给药期限不能设定。
剂量推荐
成人术后接受口服本品治疗的推荐起始剂量:
对肝移植患者,口服初始剂量应为按体重每日0.1~0.2mg/kg,分两次口服,术后6小时开始用药。
对肾移植患者,口服初始剂量应为按体重每日0.15~0.3mg/kg,分两次口服,术后24小时内开始用药。
移植术后的剂量调整
通常在移植术后降低本品的给药剂量。某些情况下可停止联合免疫抑制治疗而改用普乐可复单独治疗。移植后患者情况的改善可能改变他克莫司的药代动力学,可能需要进一步调整剂量。
治疗排斥反应
增加本品的剂量、补充类固醇激素治疗、介入短期的单克隆或多克隆抗体都可用于控制排斥反应。如果出现中毒征兆(如明显的不良反应一见不良反应),可能需要减少本品的剂量。
由其他治疗转换为普乐可复治疗,应以推荐的术后口服起始剂量开始治疗。
患者由环孢素转换成本品,本品的首次给药间隔时间不超过24小时。如果环孢素的血药浓度过高,应进一步延缓给药时间。
特殊人群剂量调整
肝损伤患者
对于严重肝损伤患者可能需要降低剂量以维持全血谷浓度在推荐的目标范围内。
肾损伤患者
他克莫司药代动力学不受肾功能影响,因此不需要进行剂量调整。然而由于他克莫司潜在的肾毒性,推荐对肾功能进行严密监测(包括连续的血肌酐浓度、肌酐清除率计算和尿量监测)。
儿童患者:参见“儿童用药”项下。
老年患者:参见“老年用药”项下。
推荐的目标全血谷浓度
给药剂量主要基于对每位患者排斥反应和耐受性的临床评估。他克莫司属于治疗窗狭窄的药物,治疗剂量和中毒剂量相当接近,且个体间和个体内差异大,因此,移植术后应该监测他克莫司的全血谷浓度。
目前有一些免疫测定方法用于测定他克莫司全血浓度包括半自动微粒酶免疫测定法(MEIA),以优化给药。将临床测得的个体浓度值与文献发表的浓度值比较时,应慎重并考虑所选的测定方法。在目前临床实践中,用免疫测定方法来监测全血浓度。
口服给药时,应在给药后约12小时左右即在下次给药前测定谷浓度。全血谷浓度监测频率根据临床需要而定。由于普乐可复为低清除率药物,调整剂量并维持数日,直至血药浓度达稳态方可进行下一次调整。
肝移植患者:临床实践中理想的监测时间为开始服药后的第2天或第3天,移植术后的前1~2周,每周平均监测3次,以后逐渐减少,第3~4周每周2次,第5~6周每周1次,第7~12周每2周1次。维持治疗期应定期监测。
肾移植患者:移植术后的前1~2周,每周平均监测1~2次,以后逐渐减少,第3~4周每周1次,第5~12周每2周1次。维持治疗期应定期监测。
特殊情况下,如肝功能改变、出现副作用、使用能改变他克莫司药代动力学的药物等时,必须增加监测频率。应在剂量调整、免疫抑制方案改变或与其他可能改变他克莫司全血谷浓度的药物一同服用后监测他克莫司全血谷浓度。
临床研究分析表明,他克莫司全血谷浓度维持在20ng/ml以下,大多数患者临床状况可控。因此当说明全血谷浓度时要考虑患者的临床状况。
肝移植患者:术后1个月内目标全血谷浓度为10~15ng/ml,第2~3个月为7~11ng/ml,3个月后为5.0~8.0ng/ml并维持。
肾移植患者:术后1个月内目标全血谷浓度为6~15ng/ml,第2~3个月为8~15ng/ml,第4~6个月为7~12ng/ml,6个月后为5~10ng/ml并维持。
不良反应由于患者的基础疾病和同时服用多种药物,与免疫抑制药物相关的不良反应通常很难确立。
下述药物不良反应均为可逆性的或降低剂量后可减轻或消失。与静脉给药相比,口服给药的不良反应发生率更低。以下药物不良反应按照发生频率山高到低列出:极常见(≥1/10);常见(≥1/100;




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国