盐酸阿扎司琼氯化钠注射液,适应症为用于细胞毒类药物化疗引起的呕吐。
成份本品主要成份为:盐酸阿扎司琼。
化学名称:(±)N-(1-氮杂双环[2,2,2]-3-辛基)-6-氯-3,4-二氢-4-甲基-3-氧代-2H-1,4-苯并噁嗪-8-甲酰胺单盐酸盐。
化学结构式:
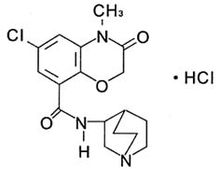
分子式:C17H20ClN303.HCl
分子量:386.28
辅料为氯化钠。
性状本品为无色或几乎无色的澄明液体。
适应症用于细胞毒类药物化疗引起的呕吐。
规格100ml:盐酸阿扎司琼10mg与氯化钠0.9g。
用法用量每日一次10ml(一次1瓶),于化疗前30分钟静脉滴注。
不良反应部分病人出现口渴、便秘、头痛、头晕、腹部不适等。上述反应轻微,无须特殊处理。严重者曾有发生过过敏性休克的报道。故使用本品时应密切观察病人的反应,如发生异常应立即停药,并给予适当处理。
禁忌1.对本类药物(5-HT3受体阻断剂)及本品过敏者禁用。
2.胃肠道梗阻者禁用。
注意事项本品遇光易分解,注意避光。
孕妇及哺乳期妇女用药1.孕妇除非必须外,不宜使用。
2.哺乳期妇女慎用,使用本品时应停止哺乳。
儿童用药尚未确定小儿用药的安全性。
老年用药本品主要从肾脏排泄,由于高龄患者多见肾功能降低,会持续血中高浓度,并可能出现头痛等副作用。因此应根据患者状态给药。出现副作用时应减量(例如5mg)。
药物相互作用1、本品与碱性药液(如呋喃苯胺酸、甲氨蝶呤、氟尿嘧啶、吡咯他尼等注射液)或鬼臼乙叉苷注射液配伍会发生浑浊或结晶析出。故不宜与上述药物同时应用。
2、本品与氟氧头孢钠注射液配伍使用可能会使本品的含量降低,故应在配制后6小时内使用。
3、本品与地西泮注射液配伍会出现浑浊或产生沉淀,应避免与之配伍使用。
药物过量未进行该项试验且无可靠参考文献。
药理毒理1.药理作用
盐酸阿扎司琼为选择性5-HT3受体拮抗剂,对顺铂等抗癌药引起的恶心及呕吐有明显抑制作用。动物研究表明,盐酸阿扎司琼对大鼠大脑皮质5-HT3受体亲和力比甲氧氯普胺约强410倍,为恩丹西酮的2倍,与格拉司琼基本相同。
2.毒理研究
重复给药毒性:本品大鼠静脉注射给药,10mg/kg和60mg/kg组动物出现进食量和体重增加,可逆性的心脏、肝脏、脑和肾上腺重量加大。狗连续静脉注射给药3个月,剂量达30mg/kg时,给药后即刻出现呕吐和流涎等症状。
生殖毒性:大鼠妊娠前及妊娠初期给药剂量60mg/kg时,对母体动物的生殖功能及胎仔发育未见明显影响。大鼠器官形成期静脉注射剂量达100mg/kg时,出现胎盘重量(F1)减少及雄性新生鼠(F1)的肾脏及肾上腺重量增加,但对母体、胎仔(F1和F2)及新生鼠(F1)的发育和功能均未表现出明显影响。家兔静脉注射给药剂量达0.3mg/kg时,出现母体动物摄食量减少,剂量达3.0mg/kg出现胎仔发育轻度抑制,达30mg/kg时出现胎仔死亡率轻度增加,但未出现致畸性。大鼠围产期静脉注射给药达100mg/kg时,对母体动物无明显影响,但雄性仔鼠出现肝脏重量稍减轻。动物研究结果已表明,本品可经大鼠乳汁分泌,故哺乳期妇女在本品用药期间应中止授乳。
遗传毒性:本品Ames试验和小鼠微核试验结果均为阴性,但体外培养细胞染色体畸变试验结果出现染色体结构异常。
药代动力学据文献报道,健康男性志愿者静注本品10mg后,3分钟的血浆中原型药的浓度为190.5μg/ml,其药动学是线性的。本品呈双向消除,α相和β相的半衰期分别为0.13h和4.3h。对接受顺铂治疗的恶性肿瘤患者,静注本品10mg后,终末半衰期为7.3±1.2h,较健康人长。原型药24h由尿排泄量为剂量的64.3±15%。
贮藏遮光、密闭保存。
包装包装材质为玻璃输液瓶,100ml/瓶。
有效期18个月。
执行标准国家食品药品监督管理局标准 YBH11782004。1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国