碘帕醇注射液,适应症为**神经放射学:**脊髓神经根造影术,脑池造影和脑室造影术。**血管造影术:**脑动脉造影术,冠状动脉造影术,胸主动脉和腹主动脉造影术, 心血管造影术,选择性内脏动脉造影术,周围动脉造影术和静脉造影术。大脑动脉,周围动脉及腹部动脉的数字减影血管造影术。**泌尿系造影术:**静脉尿路造影术。CT检查中增强扫描。关节造影术,瘘道造影术。数字减影血管造影术。
成份本品主要成分为碘帕醇,化学名为(S)—N,N’ —双[2—羟基—1—(羟甲基)乙基]—5—[(2—羟基—1—氧化丙基)氨基]—2,4,6—三碘—1,3—苯二甲酰胺。
其结构式为:
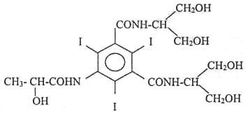
分子式: C17H22I3N3O8
分子量: 777.09
本品所含辅料包括:氨基丁三醇,依地酸二钠,盐酸(调节PH值)及注射用水
性状本品为无色的澄明液体。
适应症神经放射学: 脊髓神经根造影术,脑池造影和脑室造影术。
血管造影术: 脑动脉造影术,冠状动脉造影术,胸主动脉和腹主动脉造影术, 心血管造影术,选择性内脏动脉造影术,周围动脉造影术和静脉造影术。大脑动脉,周围动脉及腹部动脉的数字减影血管造影术。
泌尿系造影术: 静脉尿路造影术。
CT检查中增强扫描。
关节造影术,瘘道造影术。数字减影血管造影术。
规格(1)9 g(I)/30 ml/瓶
(2)15 g(I)/50 ml/瓶
(3)30 g(I)/100 ml/瓶
(4)11.1g(I)/30 ml/瓶
(5)18.5 g(I)/50 ml/瓶
(6)37 g(I)/100 ml/瓶
用法用量根据不同的X线检查需要,选择不同的浓度与剂量。
神经放射学
浓度(mg/ml) 推荐剂量(ml)
脊髓神经根造影 200-300 5-15
脑池和脑室造影 200-300 5-15
血管造影
浓度(mg/ml) 推荐剂量(ml)
脑血管造影 300 5-10(团注)
冠状动脉造影 370 8-15(团注)
心血管造影 370 1.0-1.2/公斤
胸主动脉造影 370 1.0-1.2/公斤
腹主动脉造影 370 1.0-1.2/公斤
选择性内脏动脉造影 300-370 取决于检查需要
周围动脉造影 300-370 40-50
数字减影血管造影 150-370 取决于检查需要
静脉造影 300 30-50
尿路造影
浓度为300-370毫克碘/毫升的碘帕醇注射液(碘比乐® 300-370)均可用于尿路造影,建议剂量为30至50毫升。
由于碘比乐® 370毫克碘/毫升引起的渗透性利尿作用较低,使其特别适用于轻或中度肾功能不全患者和新生儿。甚至对严重肾功能不全患者仍可获得有诊断价值的肾造影。
其他诊断检查
浓度(mg/ml) 推荐剂量(ml)
CT增强扫描 300-370 0.5-2.0/公斤
关节造影 300 取决于检查需要
楼管造影 300 取决于检查需要
用于CT增强扫描,造影剂可静脉团注或静脉滴注。亦可二者并用。
不良反应概述
应用有机碘化合物可引起不良反应,以及过敏性或药物性休克。
大约0.02%的患者应用碘帕醇后出现不良反应。通常为轻至中度且为一过性的,曾有罕见的严重和致命性反应有时导致死亡的报告。绝大多数不良反应在用药后几分钟内出现,但也有迟发的通常是皮肤过敏反应,常出现在药物注射后2-3天;极少数病例发生在药物注射后7天内。
过敏反应(过敏样反应/超敏感性)可以表现为:轻度局限性或弥散性血管神经性水肿,舌水肿,喉痉挛,喉水肿,吞咽困难,咽炎以及咽喉发紧,咽喉痛,咳嗽,结膜炎,鼻炎,喷嚏,热感,出汗增加,衰弱(无力),头晕,苍白,呼吸困难,喘息(喘鸣),支气管痉挛和中度低血压。皮肤反应可能有多种形式的皮疹,播散性(弥散性)红斑,播散性(弥散性)水疱,荨麻疹和瘙痒。这些反应的发生与给药剂量和给药途径无关,有可能是休克初期的首发症状。必须立即停止给药,如果必要,建立静脉通路给予对症治疗。
较为严重的不良反应可累及心血管系统,例如血管扩张伴有显著的低血压、心动过速、呼吸困难、焦虑、发绀和意识丧失(昏厥),这些需要急救治疗。
注射部位肿痛可能发生。极罕见发生造影剂外溢而致局部炎症,皮肤坏死和腔隙症侯群。
与其他碘造影剂相同,非常罕见的皮肤粘膜综合症包括Stevens-Johnson综合症、毒性表皮坏死松解(Lyell综合症)及多形性红癍,在注射碘帕醇后曾有报告。
血管内注射
最常报告的不良反应为恶心、呕吐、荨麻疹、瘙痒和呼吸困难。
血管内注射后自发报告的不良反应为:

鞘内注射
脊髓造影后的不良反应多出现在鞘内注射后数小时,这是因为造影剂从注射部位缓慢吸收并分布至全身脏器。通常发生在注射后24小时内。
头痛、惊厥、恶心、呕吐和肢端痛为最常见的不良反应。
过敏反应可能发生(过敏样反应/高敏)。请参见**“概述”**。鞘内注射后过敏样反应伴随循环紊乱,如严重低血压导致昏厥或心跳骤停和危及生命的休克不及血管内注射后常见。呼吸方面(呼吸困难或表现为支气管痉挛的呼吸窘迫)和皮肤粘膜(荨麻疹,血管神经性水肿及其它皮肤反应如皮疹)的不良反应也不及血管内注射后常见。
来自上市后不良反应报告包括:

体腔应用
大多数不良反应发生在造影剂注射后数小时,这是由于造影剂从注射区域缓慢吸收并分布至全身脏器。
血淀粉酶升高常见于ERCP检查后。罕见有胰腺炎。
关节造影和瘘管造影病例发生的不良反应通常表现为对已有炎性组织的刺激。
全身性过敏反应罕见,通常为轻度,并表现为皮肤反应。但是,发生严重过敏样反应的可能性不能排除。过敏样反应的全文请参考**“概述”**一章。
禁忌典比乐®无绝对禁忌症,仅在Waldenstrom's巨球蛋白血症、多发性骨髓瘤和严重肝肾疾病中不适用。
当怀疑或确定为妊娠时,以及在急性炎症期间,禁忌对女性生殖道进行放射学检查。
典比乐®与皮质类固醇不能同时在鞘内注射。
严重的局部或全身感染可能伴菌血症时不能行脊髓造影检查。
为避免药物过量,当发生技术操作失误时,不能立即重复进行脊髓造影检查。
注意事项不要限制婴儿与儿童的水摄入,在使用高渗造影剂前纠正水或电解质紊乱。
妊娠妇女和甲亢患者只有在医生认为确有必要的情况下才能使用。
造影检查只能用于那些确实符合诊断用造影剂适应症的病人,而这需要通过病人的实际临床情况来判断,特别应注意病人已经存在的心血管、泌尿系统或肝胆系统的病理状况。
造影剂只能在有抢救设施及人员的医院和诊所中应用。
在放射科,使用造影剂的诊断检查较常见,应全天候配备所有必要的设备和药物以应对任何紧急情况的出现(救护气囊,氧气,抗组胺药,血管收缩药,可的松等)。
[u]用于神经放射学检查注意事项[/u]
万一液体流动受阻,应尽最大可能放出注入的造影剂。有癫痫史者忌用有机碘造影剂。
血性脑脊液者禁用典比乐,此时医生应权衡检查之必要性,避免冒险。
使用抗惊厥药物者,在造影检查前、后必须连续用药,检查期间若有发作,建议静脉注射安定或苯巴比妥钠。
[u]用于血管造影注意事项:[/u]
晚期动脉硬化、高血压,心力衰竭,严重的全身性疾患和近期脑栓塞或血栓形成者发生严重不良反应的机会增多。
心血管造影时,应特别注意右心功能及肺循环状况;万一出现了心衰,额外的造影剂容量可诱发伴心动过缓和全身性低血压的循环负荷过量。在伴肺动脉高压和心功能不全的紫绀新生儿,将造影剂注入右心时应特别注意。
检查主动脉弓时,建议小心放置导管头。由注射器传入头臂动脉分枝处过高的压力可引起低血压、心动过缓和中枢神经系统损伤。
同样,在腹主动脉造影时,来自高压注射器的过高压力可引起肾梗塞、脊髓损伤、腹膜后出血、肠梗塞和坏死。
体外试验观察到,相同浓度的非离子型造影剂与离子型造影剂相比,其对凝血活性的抑制作用低。
请正确按照血管造影术的操作程序进行:使用肝素化盐水对血管内的导管进行频繁冲洗,并避免造影剂在导管及注射器内与血液长时间接触。
在周围动脉造影时,典比乐R370mgl/Ml注射液可引起疼痛反应,而典比乐R300mgl/ml注射液则无此现象。
碘过敏试验:由于碘过敏试验不能预测造影剂是否会发生严重或致命的反应,所以建议不进行碘过敏试验。
孕妇及哺乳期妇女用药在大鼠和家兔的生殖性研究中,分别给予人用最高推荐剂量(1.48gI/kg)的2.7倍和1.4倍的典比乐®,未发现典比乐®对生育力或胎儿有损害。但是没有任何对孕妇的研究,因此只有当医生认为必需时才能对孕妇注射典比乐®。
目前并不知道典比乐®是否通过人乳分泌。虽然尚无乳婴严重不良事件的报告,但由于许多注射用造影剂在人乳中分泌,因此当典比乐®用于哺乳期妇女时仍需非常小心。
儿童用药婴儿使用前,必需纠正水与电解质平衡失调。
老年用药无特殊注意事项,请参见各种用途注意事项。
药物相互作用造影剂不能与其它药物混合。预约用放射性碘做甲状腺检查者,应牢记在使用经肾排泄的含碘造影剂后,甲状腺会减少对碘的摄取达数天甚至二周。
必须绝对避免使用可以降低癫痫发作阈值的神经安定类(精神抑制药)、镇痛类、抗组胺类和吩噻嗪类镇静药。如必须使用,应在注射造影剂至少48小时前停药,且在检查结束12小时以后才可重新用药。
药物过量不推荐使用超过说明书规定的剂量,因为由此可引起致命的不良反应。
如果需要,可以采用血液透析以清除体内的碘帕醇。
药物过量的治疗采用对所有生命功能的直接支持措施和迅速对症治疗。
[u]血管内[/u]
血管内注射意外过量时,应输液补充丢失的水和电解质。对肾功能实行至少3无的监测。
[u]鞘内[/u]
鞘内注射过量的体征:上行性反射亢进或强直阵发性痉挛,直至全身性发作,累及中枢的严重病例,可出现高热,昏迷和呼吸抑制。
药理毒理毒理学、遗传毒性和生殖性的临床前研究数据未显示碘帕醇对人粪有特殊的毒性。
通过对狗的研究证实,碘帕醇在高于临床人体用量2-4倍的剂量时可以引起一过性心动过缓和低血压,继而代以轻微的高血压以及呼吸频率增加。这些作用被证实是可逆的,在停药后2-4分钟恢复。
药代动力学碘帕醇注射后绝大部分以原形经肾脏排除。给狗用药后,7-10小时内有93-95%的药量经肾脏和0.5%的药量经胆囊排泄。
在人体,药量的90%以上在24小时内通过肾脏排出。
血中浓度半衰期,消除相,狗约为60分钟,而人为90-120分钟。
鞘内注射后在90-150分钟内达血浆浓度峰值,并且于24小时内全部排出。
在动物和人体内碘帕醇均无明显的代谢。
贮藏30C以下避光保存。
请于使用前打开药瓶,一旦开瓶应立即使用,任何未用完的药液必须丢弃。
偶然会发现碘必乐溶液瓶内有结晶现象。已证明这种现象是由于容器有缺陷或损坏引起,此时瓶内溶液已不能使用。
碘必乐®与其它的含碘造影剂相同,可能与含铜的金属表面发生反应(如黄铜),因此应避免使用产品会与这类金属表面直接接触的仪器。
包装玻璃瓶,10瓶/盒。
有效期60个月
执行标准YBH061420081




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国