氢溴酸加兰他敏片,适应症为氢溴酸加兰他敏片用于治疗轻度到中度阿尔茨海默型痴呆症状。
成份主要成份:氢溴酸加兰他敏。
化学名称:11—甲基—3—甲氧基—4α,5,9,10,11,12—六氢—6H—苯并呋喃[3α,3,2—ef][2]—苯并氮杂卓—6—醇氢溴酸盐。
化学结构式:
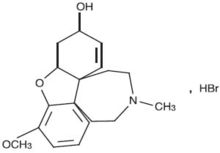
分子式:C17H21NO3·HBr
分子量:368.27
性状本品为类白色圆形薄膜包衣片(4mg)、粉红色圆形薄膜包衣片(8mg),除去薄膜衣后均显白色。
适应症氢溴酸加兰他敏片用于治疗轻度到中度阿尔茨海默型痴呆症状。
规格4mg,8mg(按加兰他敏计)。
用法用量用药说明
口服,一日2次,建议与早餐及晚餐同服。
起始剂量:
推荐剂量为一次4mg,一日2次,服用4周。治疗过程中保证足够液体摄入。
维持剂量:
初始维持剂量为一次8mg,一日2次,此剂量下,患者至少维持4周。
医师在对患者临床疗效及耐受性进行综合评价后,可以将剂量提高到临床最高推荐剂量,一次12mg,一日2次。
服用本品请参照以上推荐方案或遵医嘱。特殊人群用药注意事项参见说明书相关部分。本品无撤药反应。
特殊人群剂量
肝肾功能损害患者用药
中度和重度肝肾功能损害患者可能造成加兰他敏的血药浓度升高。
有中度肝功能损害患者在服药的第一个星期应从一次4mg,一日1次开始,最好在早晨服药。然后加到一次4mg,一日2次,至少保持4周。这些患者,加兰他敏的维持剂量不应超过一次8mg,一日2次。
不建议严重肝功能损害的患者使用加兰他敏。
肌酐清除率高于9ml/min的肾功能损害患者无需进行剂量调整。
而肌酐清除率低于9ml/min的严重肾功能损害患者因为缺乏研究数据,所以不建议使用加兰他敏。
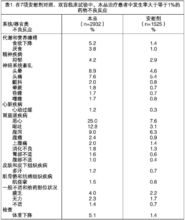
不良反应双盲数据——报告发生率大于等于1%的药物不良反应
对参见了7项安慰剂对照,双盲临床试验的轻度到中重度阿尔茨海默型痴呆的4457名患者进行了本品安全性评价。所有数据信息如下。
本品治疗患者中发生率大于等于1%的报告药物不良反应(ADRs)见表1。
开放标签数据——发生率大于等于1%的药物不良反应
对参加了5项开放标签临床试验的阿尔茨海默型轻度到中重度阿尔茨海默型痴呆的1454名患者进行了本品安全性评价。所有数据信息如下。
在这些试验中,本品治疗患者中发生率大于等于1%的药物不良反应(包括跌倒,在开放标签试验中发生率为6.5%)并且没有出现在表1中的。
双盲和开放标签数据——发生率小于1%的药物不良反应
在双盲和开放标签临床试验数据集中,本品治疗患者中发生率小于1%的药物不良反应列于见表2中。

【注释:下面两个表格所列的个人事件相同。这两个表格的不同之处是用于评价每个事件发生频率的信息来源,表3是自发报告的发生率,表4是流行病学或临床试验的精确发生率。当从公司核心说明书收集当地标签,要根据当地法规要求或指导原则,这两个表格只有一个作为上市后的数据。在表3中,列出的是基于自发报告发生率按频率分类的药物不良反应。在表4中,列出的是基于临床试验发生率按频率分类的药物不良反应。】


禁忌对本品中活性成份氢溴酸加兰他敏及辅料过敏的患者禁用。
注意事项本品用于治疗轻度到中重度阿尔茨海默型痴呆。没有显示出加兰他敏有治疗其他类型的痴呆或其他类型的记忆缺陷症状的疗效。
阿尔茨海默病患者本身体重会降低。使用乙酰胆碱酯酶抑制剂类药物,包括加兰他敏,患者会伴随体重减少。因此在治疗过程中,应监测患者的体重情况。
与其它拟胆碱能药物一样,有以下病症的患者服用加兰他敏需慎重:
心血管系统:
拟胆碱能药物共性的药理作用,即可能对心率产生迷走神经兴奋作用(如心动过缓)。因此患有病窦综合征、其它室上性心脏传导阻滞或合并使用地高辛及β-阻滞剂等能够明显导致心率减缓的药物的患者,在服用加兰他敏时应特别慎重。在临床研究中发现,使用加兰他敏的患者出现过晕厥,罕见有严重的心动过缓。
胃肠道系统:
消化性溃疡高危患者(如:有溃疡病史或有此病易患因素的患者,及正在服用非甾体抗炎药的患者)在服药期间,应密切注意症状。然而,临床研究表明,与安慰剂相比,使用加兰他敏并不增加患者罹患消化性溃疡或消化道出血的机率。胃肠道梗阻或胃肠道术后恢复期的患者,建议不要使用加兰他敏。
神经系统:
拟胆碱能药物有可能会引起癫痫发作。然而,对于阿尔茨海默病患者而言,这种发作也可能是疾病本身的一个临床症状。
呼吸系统:
考虑到拟胆碱能药物的药理作用,对于有严重哮喘或阻塞性肺病的患者,处方拟胆碱能药物应谨慎。
泌尿系统:
建议尿路阻塞或膀胱术后恢复期的患者不要使用加兰他敏。
在轻度认知缺陷(MCI)患者中的安全性
本品不适用于治疗轻度MCI的患者,相当于他们的年龄和教育程度,他们的记忆缺陷要比预期的严重,但并不满足阿尔茨海默病的标准。
第二,在MCI患者中进行的2年对照试验并不满足主要药效学结果。即使两个治疗组的死亡率低,加兰他敏组最初记录的患者死亡数要比安慰剂组多,但治疗组间的严重不良事件发生率是相等的。在老年人群中由各种原因引起的死亡没有异常。收集回来的主要人群数据,包括那些在随机双盲期之前退出试验的患者,没有证据表明加兰他敏会增加死亡的风险。在死亡之前退出试验的患者想安慰剂组中要多于加兰他敏组,这可能是最初记录的死亡率不同的原因。
MCI研究的结果和阿尔茨海默病研究结果有一定差异。在所有阿尔茨海默病研究(n=4614)中,安慰剂组的死亡率要高于加兰他敏组。
对驾驶及机械操作能力的影响:
患有阿尔茨海默病会导致患者驾驶能力逐渐丧失或操作机械能力的减弱。同其它拟胆碱能药物一样,加兰他敏可能引起头晕、嗜睡,会影响患者驾驶及操作机械的能力,特别是在服药的第一个星期内。
请置于儿童不易拿到处。
孕妇及哺乳期妇女用药妊娠期:
在孕大鼠给药剂量至16mg/Kg(相当于人体治疗剂量的25倍)以及孕家兔给药至40mg/Kg(相当于人体治疗剂量的63倍)进行的生殖毒性试验中,未发现潜在致畸作用。在16mg/Kg剂量下大鼠骨骼异常的发生率有所增加,但是不具统计学意义。
尚无孕妇服用加兰他敏的数据。因此孕妇服用加兰他敏应权衡利弊。
哺乳期:
尚不明确加兰他敏是否从母乳排出,对哺乳期妇女尚无研究数据。因此,服用本品的妇女不应哺乳。
儿童用药尚无儿童使用加兰他敏的数据,因此不建议儿童使用加兰他敏。
老年用药尚未进行老年用药的相关研究,但从阿尔茨海默病患者临床数据显示,加兰他敏血药浓度在老年患者中比健康年轻患者高30%-40%。
药物相互作用药效学相互作用:
考虑到加兰他敏的作用机理,它不应该与其它拟胆碱能药物同服。加兰他敏能够拮抗抗胆碱能药物。拟胆碱能药物与能够显著减缓心率的药物(如地高辛及β-阻滞剂)可能会产生药效学方面的相互作用。
作为一种拟胆碱能药物,加兰他敏能够加强麻醉过程中琥珀酰胆碱类药物的肌松作用。
药代动力学相互作用:
加兰他敏体内清除包括多种代谢途径并经肾脏排泄。体外加兰他敏研究表明,CYP3A4和CYP2D6是参与加兰他敏代谢的主要酶。
抑制胃酸分泌不会影响加兰他敏的吸收。
其它药物对加兰他敏代谢的影响:
CYP3A4或CYP2D6酶的强抑制剂能够增加加兰他敏的AUC。多剂量给药药代动力学研究证明,加兰他敏在与酮康唑及帕罗西汀同服时AUC分别增加了30%和40%。而另外一个CYP3A4酶抑制剂红霉素仅使加兰他敏的AUC增加了10%。阿尔茨海默病患者人群药代动力学分析显示,与CYP2D6酶抑制剂(阿米替林、氟西汀、氟伏沙明、帕罗西汀及奎尼丁)同服,加兰他敏的清除率减少了约25%-33%。
因此,在使用加兰他敏治疗初期,与CYP2D6或CYP3A4酶的强抑制剂同服时,患者胆碱能副作用发生率会升高,主要是恶心及呕吐。这种情况下,医生应根据患者的耐受性考虑调低加兰他敏维持剂量。
美金刚,N-甲基-D-天冬氨酸(NMDA)受体结抗剂,10mg/日给药2日,然后一次10mg,一日2次,给药12日,对加兰他敏16mg/日的稳态药代动力学无影响。
加兰他敏对其它药物代谢的影响:
加兰他敏一次12mg,一日2次给药,对华法令和地高辛的药代动力学没有影响,而且对华法令诱导的凝血酶原时间延长没有影响。
体外研究表明,加兰他敏对细胞色素P450主要同工酶的抑制作用很低。
药物过量症状:
加兰他敏主要的药物过量症状和体征与其它拟胆碱能抑制剂相似。主要涉及中枢神经系统、副交感神经系统及神经肌肉接头。除肌肉无力或肌束震颤外,胆碱能危象体征可能部分或全部出现:严重恶心、呕吐、胃肠道痉挛、流涎、流泪、排尿、排便、出汗、心动过缓、高血压、虚脱及惊厥。肌无力并发气管分泌物过多及支气管痉挛可以导致致命的气道不畅。
上市后报告过一个病例,在1天内服用了8片4mg片(共32mg)后出现以下症状:心动过缓、QT间期延长、室性心动过速及尖端扭转型室速并伴有暂时意识丧失。另有误服32mg本品的两个病例及40mg本品的一个病例,分别出现了以下症状:恶心、呕吐及口干;恶心、呕吐及胸骨下胸痛;呕吐,误服后经短期住院治疗痊愈。另一位患者,在服药时的前两年内一直有幻觉症状,误将每日24mg本品的处方看作每日2次,每次24mg,服用本品达34天,导致需住院治疗的幻觉症状。还有一位患者,处方为每日16mg的口服液,结果误服了160mg(40ml),服药1小时后,出现出汗、呕吐、心动过缓及接近晕厥,该患者进行了住院治疗,24小时后症状缓解。
治疗:
药物过量时,应采取支持性疗法。严重情况下,可以服用抗胆碱能药物如阿托品治疗。建议静脉给药,初始剂量为静注0.5-1.0mg,然后根据患者临床反应调整剂量。
因为药物过量的治疗方法在不断更新,因此发生药物过量时应与有关专业机构联系以获取最佳方法。
临床试验临床试验结果表明加兰他敏治疗阿尔茨海默病的有效剂量为16,24及32mg/天。以上剂量中,从疗效及耐受性两个方面综合评价显示,16,24mg/天剂量具有最佳的利益风险比,可作为临床推荐用药剂量。在临床试验中采用以下四种专属的量表来评价加兰他敏的疗效:ADAS-Cog评定量表(通过患者行为状况测定患者认知功能)、CIBIC-plus评定量表(医师通过对患者及照料者的临床问诊进行整体评价)、日常生活能力评定量表及神经精神科问卷(NPI,行为障碍评定量表)。
临床研究中,以ADAS-Cog(见图)及CIBIC-plus量表评定时,加兰他敏组患者的疗效显著优于安慰剂组患者。患者服用加兰他敏6个月后,其ADAS-cog评分较基线有显著性改善,与未用加兰他敏治疗的患者相比,表现出显著且稳定的认知功能改善。同时,加兰他敏能够显著维持患者日常生活能力,如:穿衣、个人卫生、做饭等,采用的评定量表如下:痴呆残疾评定量表(DAD)、阿尔茨海默病协作学习-日常生活能力问卷及照料者评定量表。NPI评分结果显示:16和24mg/天治疗组在整个治疗期内患者的行为基本无变化,而安慰剂组患者出现行为障碍。
图1:ADAS-Cog/11评分较基线改变的均值(±SE)-时间图(GAL-USA-1及GAL-INT-1两个试验的荟萃分析)
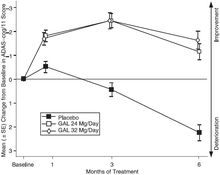
图2:ADAS-Cog/11评分较基线改变的均值(±SE)-时间图(全部有数据的患者统计)(GAL-USA-10)

长期治疗试验(6个月双盲试验续以6个月开放治疗期)表明患者在一年的治疗期能够维持认知功能及行为能力。
伴有脑血管病的阿尔茨海默病(AD+CVD)
在一项双盲,安慰剂对照的研究中进行了加兰他敏在伴有脑血管病的阿尔茨海默病患者中(AD+CVD)的有效性和安全性研究。有282个受试者符合AD+CVD的标准,占总研究人群的48%(共592人)。尽管临床试验没有亚组的分析,但与安慰剂治疗组的患者相比,加兰他敏治疗组的患者在主要结果上具有统计学显著改善(认知:ADAS-cog/11[p




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国