铍化合物(beryllium compounds)一般无色,起氯化物和硫酸盐易溶于水,氧化物、碳酸盐和磷酸盐难溶于水。氧化铍和氢氧化铍具有两性,既溶于酸又溶于碱。氧化铍主要用于知趣铍盐和耐火材料。铍化合物有高毒性,会使人中毒。
概述铍化合物一般无色,起氯化物和硫酸盐易溶于水,氧化物、碳酸盐和磷酸盐难溶于水。氧化铍和氢氧化铍具有两性,既溶于酸又溶于碱。氧化铍主要用于以知趣铍盐和耐火材料。铍化合物有高毒性。可溶性铍化合物(如BeCl2、BeF2、BeSO4等)的毒性高于不溶性化合物。高分散度的粉尘、烟雾吸入后,初期使肺硬化,肺泡上皮组织变形,后期可发生恶性肿瘤。从事金属铍溶炼、铸造、加工的人工吸入BeSO4和BeF2达1mg时即发生急性中毒。慢性中毒潜伏期约数周到10年以上,即使停止接触,仍会发病。1
铍的化学性质铍较低的原子半径和离子半径决定了它的化学性质。其电离能非常高,与其他原子键合时有很强的极化性,所以所有铍化合物都属于共价化合物。根据对角线规则,与元素周期表中邻近的元素相比,铍的化学性质更接近铝,因为两者的电荷半径之比都很高。铍的表面会形成氧化层,有效避免进一步被空气氧化;要加热至1000°C以上,铍才会继续和空气发生反应。燃烧中的铍会产生明亮的光芒,并形成氧化铍和氮化铍。铍易溶于如氢氯酸和稀释硫酸等非氧化酸,但不溶于的硝酸和水。和铝一样,铍在水中会形成氢氧化物保护层,避免进一步反应。铍也可以溶于碱溶液中。1
铍原子的电子排布为[He] 2s2。由于有两个价电子,所以铍几乎永远以+2氧化态形成两个共价键。+1态较罕见,如须在高温下制备、在低温下会歧化的的一氯化铍。根据八隅体规则,原子会尽量达到8价状态,使电子排布接近稀有气体元素。铍在形成两个共价键后会有4个价电子,即八隅体的一半,所以铍的配位数为4。这一配位数使氟化铍和氯化铍等铍化合物能够形成聚合物。
硫酸铍和硝酸铍等铍盐溶液呈酸性,因为[Be(H2O)4]离子会进行水解反应:
[Be(H2O)4]+ H2O[Be(H2O)3(OH)]+ H3O
水解的产物还包括[Be3(OH)3(H2O)6]三聚体离子。氢氧化铍(Be(OH)2)属于两性化合物,可溶于强碱溶液中,但不可溶于中性和酸性溶液中。
铍可以和许多非金属形成二元化合物,包括与氟、氯、溴和碘所形成的无水卤化物。氟化铍(BeF2)的结构类似于二氧化硅,形成角与角相接的BeF4四面体形。氯化铍(BeCl2)和溴化铍(BeBr2)具有链条状结构,形成边与边相接的四面体形。气态下的卤化铍形成线形单体分子结构。
氟化铍(BeF2)是比较特殊的二氟化物:其共价性质比其他碱土金属的氟化物强得多,但仍比其他卤化铍更接近离子化合物。它和二氧化硅(SiO2)有许多相似之处。两者都形成四面体配位结构,并会玻璃化。氟化铍的室温晶体结构和某些高温结构都和石英相同。与其他碱土金属氟化物不同的是,氟化铍易溶于水。由于氟化铍具有部分共价键性质,所以它在水溶和熔融状态下的电导率比假设它为完全离子化合物所得数值低得多。
氧化铍(BeO)是一种白色耐火材料,晶体结构和硫化锌相同,热导率和某些金属一样高,属于两性化合物。Be(OH)2经酸处理后,可制备各种铍盐。已知铍盐包括硫化铍、硒化物和碲化物,它们都具有立方晶系结构。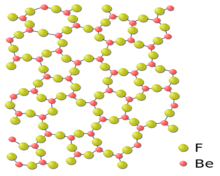
氮化铍(Be3N2)是一种可以轻易水解的高熔点化合物。铍也可以形成叠氮化铍(BeN6)。Be3P2的结构与Be3N2相似。碱式硝酸铍和碱式醋酸铍都具有四面体型结构,每个中心氧离子与四个铍原子配位。铍有几种已知的硼化物,如Be5B、Be4B、Be2B、BeB2、BeB6和BeB12。碳化铍(Be2C)是一种砖红色耐火材料,和水反应后会产生甲烷。铍没有已知的硅化物。
铍及铍化合物的提取铍在高温下对氧有很强的亲和力,在去除表面氧化层后则会对水进行还原反应,因此从化合物中萃取出铍并不容易。只有美国、中国和哈萨克斯坦有大规模的铍萃取工业。
铍一般从绿柱石提取,有用萃取剂烧结或熔化成可溶混合物两种方法。用烧结法,首先绿柱石在770°C与氟硅酸钠和碱混合,形成氟铍酸钠和二氧化硅。把氟铍酸钠加入氢氧化钠溶液,使氢氧化铍沉淀出来。用熔融法,绿柱石须磨碎成粉,并加热至1650°C。熔融物用水迅速降温,再在硫酸中重新加热至250到300°C,主要产生硫酸铍和硫酸铝。最后用氨水去除铝和硫,留下氢氧化铍。2
从氢氧化铍到铍金属也有两种途径。用第一种方法,对氢氧化铍加入水溶氟化氢铵,使四氟铍酸铵沉淀出来,沉淀物加热至1000°C后即会形成氟化铍。氟化铍在900°C与镁发生反应,形成铍细粉,继续加热至1300°C之后可得出铍金属块。用另一种方法,对氢氧化铍加热产生氧化铍,再与碳和氯发生反应形成氯化铍。氯化铍经电解后即可得出铍金属。1
铍化合物的危害人体内有大约35毫克的铍,不足以造成伤害。铍的化学性质和镁相似,所以会在酶中取代镁,破坏酶的功能。若在短时间内吸入大量或长期吸入少量的铍粉尘,都会引致肺部和循环系统肉芽肿病,是为铍中毒。铍中毒的症状可能在五年以后才开始出现,对三分之一病人致死,对其余则致残。国际癌症研究机构(IARC)将铍和铍化合物列为1类致癌物。美国职业安全与健康管理局(OSHA)为铍设下了暴露限值为:时间加权平均值每30分钟0.002mg/m,峰值0.025mg/m。美国国家职业安全卫生研究所(NIOSH)所建议的暴露限值为0.0005mg/m。铍的立即威胁生命健康值(IDLH)为4mg/m。
欧洲和美国分别在1933年和1943年开始有铍中毒所造成的化学性肺炎记录。调查指出,在1949年美国有5%的荧光灯厂工人患有铍相关的肺病。慢性铍中毒在很多方面都和结节病相似,鉴别诊断较为困难。一些参与核武器研发的早期工人也因此病逝,如曼哈顿计划成员赫伯特·安德森。3
煤渣可以做研磨剂,用于磨去坚硬表面上的油漆和铁銹。但煤渣含有铍,所以铍会在研磨过程中弥漫在空气之中,有吸入摄取的危险。
科学家在早期须辨尝各种化合物,用味觉判断铍的存在,但这种危险性极高的做法已被现代仪器完全淘汰。吸入过多的含铍飞尘会提高罹患肺癌的可能性,所以铍和铍化合物都须要小心处理,特别须避免产生飞尘。虽然铍化合物自1949年已不再用于荧光灯管中,但在今天仍有一些可能摄取铍的行业,包括:核工业、航空航天工业、铍金属的提炼与铍合金产业、电子产品产业等等。4
国际上已对在空气中和各种表面上的铍含量测量法标准达成共识(标准ASTM D7202)。方法先用稀释氟化氢铵进行溶解,再与硫化羟基苯奎宁结合,最后用荧光检测法检测铍的含量(含量越高则荧光亮度越高)。此方法的灵敏度为工作场所铍含量建议值的100倍,可在各种表面上探测微量的耐火氧化铍和硅质铍(标准ASTM D7458)。
本词条内容贡献者为:
杜强 - 高级工程师 - 中国科学院工程热物理研究所




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国