盐酸替罗非班氯化钠注射液,盐酸替罗非班注射液与肝素联用,适用于不稳定型心绞痛或非Q波心肌梗塞病人,预防心脏缺血事件,同时也适用于冠脉缺血综合征病人进行冠脉血管成形术或冠脉内斑块切除术,以预防与经治冠脉突然闭塞有关的心脏缺血并发症。
成份本品的主要成份为盐酸替罗非班,其化学名称为:N-(正丁基磺酰基)-O-[4-(4-哌啶基)丁基]-L-酪氨酸盐酸盐一水合物。
其结构式为:
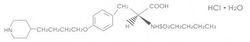
分子式:C22H36N2O5S·H2O
分子量:495.08
辅料为:氯化钠、注射用水。
性状本品为无色澄明液体。
适应症盐酸替罗非班注射液与肝素联用,适用于不稳定型心绞痛或非Q波心肌梗塞病人,预防心脏缺血事件,同时也适用于冠脉缺血综合征病人进行冠脉血管成形术或冠脉内斑块切除术,以预防与经治冠脉突然闭塞有关的心脏缺血并发症。
规格100ml:盐酸替罗非班(按C22H36N2O5S计)5mg与氯化钠0.9g。
用法用量本品仅供静脉使用,需有无菌设备。本品可与肝素联用,从同一液路输入。
建议用有刻度的输液器输入本品。必须注意避免长时间负荷输入。还应注意根据病人体重计算静脉推注剂量和滴注速率。
临床研究中的病人除有禁忌症外,均服用了阿司匹林。
不稳定型心绞痛或非Q波心肌梗塞:
盐酸替罗非班注射液与肝素联用由静脉输注,起始30分钟滴注速率为0.4ug/kg/min,起始输注量完成后,继续以0.1ug/kg/min的速率维持滴注。下表可作为按体重调整剂量的指南。
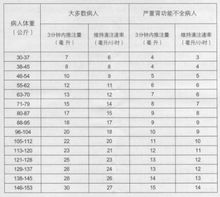
本品维持量滴注应持续36小时。以后,停用肝素。如果病人激活凝血时间小于180秒应撤掉动脉鞘管。
严重肾功能不全病人:如上面调整剂量表所特别指出的,对于严重肾功能不全的病人(肝素清除率小于30ml/min),本品的剂量应减少50%(参见注意事项,严重肾功能不全,药代动力学,病人的特点,肾功能不全)。
其他病人:对于老年病人(参见老年患者用药)或女性病人不推荐调整剂量。
使用说明
1.在使用之前应肉眼检查颗粒及变色。
2.根据上表按体重调整适当的给药速度。
3.任何剩余溶液都须丢弃。
本品可以与下列注射药物在同一条静脉输液管路中使用,如硫酸阿托品、多巴酚丁胺、多巴胺、盐酸肾上腺素、呋塞米、利多卡因、盐酸咪达唑仑、硫酸吗啡、硝酸甘油、氯化钾、盐酸普萘洛尔及法莫替丁。但是本品不能与地西泮(安定)在同一条静脉输液管路中使用。
不良反应根据文献资料,本品与肝素和阿司匹林联合治疗时,与药物有关的最常见不良事件是出血(研究者的报告通常是渗出或轻度出血)。在PRISM-PLUS(血小板受体抑制对缺血综合症的治疗—限于有不稳定的症状和体征的病人)和RESTORE(替罗非班对结果和再狭窄的随机疗效研究)研究中用TIMI**标准判定的严重和轻度出血的发生率如下:

+除有禁忌症外,病人均接受阿司匹林治疗。+血红蛋白下降大于50g/L,伴或不伴有一个确定部位的出血、颅内出血或心包填塞。
§血红蛋白下降30g/L,伴有已知部位的出血、自发性肉眼血尿、呕血或咯血。
在PRISM-PLUS研究中盐酸替罗非班与肝素联合治疗组或对照组(接受肝素治疗)均未报告有颅内出血。在RESTORE研究中颅内出血的发生率在盐酸替罗非班与肝素联合治疗组为0.1%,而对照组(接受肝素治疗)为0.3%。在PRISM-PLUS研究中,腹膜后出血的发生率在盐酸替罗非班与肝素联合治疗组和对照组分别为0.0%和0.1%。在RESTORE研究中,腹膜后出血的发生率在盐酸替罗非班与肝素联合治疗组和对照组分别为0.6%和0.3%。
接受盐酸替罗非班和肝素联合治疗或肝素单独治疗的女性和老年患者分别较男性和年轻患者有较高的出血并发症。不考虑年龄和性别因素,接受盐酸替罗非班与肝素联合治疗的患者与肝素单独治疗的患者相比,其出血的危险性增加相似。对这些人群不需调整剂量(参见用法用量,其他病人)。
接受盐酸替罗非班和肝素联合治疗的患者较对照组更易出现血小板计数下降。这种下降在中断盐酸替罗非班治疗后可逆转。血小板下降到小于90,000mm3的患者百分比为1.5%。血小板下降到小于50,000mm3患者百分比为0.3%。血小板下降见于无血小板减少症病史并再次使用血小板糖蛋白IIb/IIIa受体拮抗剂的病人。
在盐酸替罗非班和肝素联合治疗组最常见的(发生率大于1%)与药物相关的非出血性不良反应有恶心(1.7%)、发热(1.5%)和头痛(1.1%);在对照组中它们的发生率分别为1.4%、1.1%和1.2%。
在临床研究中,不良事件的发生率在不同的种族、有无高血压、糖尿病或高胆固醇血症的患者中通常是相似的。
非出血性不良事件的总发生率在女性患者(与男性患者相比)和老年患者(与年轻患者相比)中较高。但是,这些患者的非出血性不良事件的发生率在盐酸替罗非班与肝素联合治疗组和肝素单独治疗组是相似的(参见上述的出血性事件)。
以下不良反应在上市后也有报道:
出血:颅内出血、腹膜后出血、心包积血、肺(肺泡)出血和脊柱硬膜外血肿。致使性出血罕见。全身:急性及/或严重血小板计数减少可伴有寒战、轻度发热或出血并发症。超敏感性:严重变应性反应包括过敏性反应。在替罗非班输注第一天,初次治疗时以及再次使用时均有过敏性病例发生的报导。有些病例伴有严重的血小板减少症(血小板计数500mg/kg。在静脉或口服给药的研究中,未见到死亡、异常体征或与药物相关的体重改变。
在大鼠及狗中经一系列连续静脉输注5周的毒性研究评估了盐酸替罗非班的潜在毒性。使用治疗剂量达108小时都无需停药。
盐酸替罗非班的潜在致癌危险性尚未作过评估。
盐酸替罗非班在微生物及V-79哺乳类细胞的致突变实验为阴性。此外,在实验室碱性洗出液及染色体畸变实验中未见直接遗传毒性。在这些检验中盐酸替罗非班的浓度高达30mM,相当于人推荐治疗剂量的20,000倍以上。文献资料显示,盐酸替罗非班注射液经静脉用量达5 mg/kg(推荐用于人每日最大剂量的22倍)在雄性小鼠骨髓细胞中未诱发染色体畸变。
在雄性及雌性大鼠用盐酸替罗非班静脉剂量至5mg/kg/日的一项研究中,未见对生育及生殖制能力有何影响。这些剂量大约是推荐用于人体每日最高剂量的22倍以上。大鼠及兔的发育毒性研究也未见对母体或幼胎有毒性证据。再有,通过宫内接触及哺乳对大鼠性成熟的一项潜在发育毒性研究表明关于死亡、生长、发育及F1代性成熟未见与药物相关的影响。在有关发育毒性研究中,静脉输注盐酸替罗非班最高剂量达5mg/kg/日(推荐用于人每日最大剂量的22倍)。
药代动力学在0.01-25ug/ml的浓度范围内,替罗非班与血浆蛋白结合率不高,其结合率与药物浓度无关。人体血浆中不结合部分为35%。替罗非班的稳态分布容积范围为22-42升。替罗非班可以通过大鼠及兔的胎盘。
分析以及14C标记替罗非班在尿液及粪便中的代谢产物情况,表明其放射性主要来自未改变的替罗非班,循环血浆放射性主要来自未改变的替罗非班(用药后达10小时)。这些资料提示替罗非班的代谢有限。
在健康的人中以 14C标记替罗非班单次静脉给药后,在尿液,粪便中探测到的放射性分布分别占给药量的66%、23%,探测到的总放射性约为91%。替罗非班主要从尿路及胆道排出。
在健康人中替罗非班血浆清除率范围从213至314ml/min。肾脏清除率占血浆清除率的39%-69%,半衰期范围从1.4至1.8小时。
在冠心病病人中替罗非班血浆清除率范围从152至267ml/min。肾脏清除率占血浆清除率的39%,半衰期范围从1.9至2.2小时。在大鼠中,替罗非班可泌入乳汁。
病人的特点:
性别:冠心病病人中替罗非班的血浆清除率男女相似。
老年人:与较年轻病人(年龄≤65岁)相比,年龄>65岁的老年冠心病病人替罗非班血浆清除率约降低19-26%。
种族:不同种族病人未见血浆清除率有差异。
肝功能不全:在轻中度肝功能不全病人中,替罗非班的血浆清除率与健康人没有明显差异。
肾功能不全:在血浆肌酐清除率min的病人包括需要血液透析的病人中,替罗非班的血浆清除率降低到有临床意义的程度(>50%)(参见用法用量,严重肾功能不全病人)。替罗非班可以通过血液透析清除。
贮藏室温(10-30℃),密封保存。
包装玻璃输液玻瓶包装,1瓶/盒。
有效期18个月
执行标准国家食品药品监督管理局标准(试行) (YBH12132004)
1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国