注射用尿促卵泡素,用于1.治疗不排卵(包括多囊卵巢综合征)且对枸橼酸克罗米芬治疗无效者。2.辅助生殖技术超促排卵者。
成份本品为尿促卵泡素加适宜的赋形剂经冷冻干燥制得的无菌制剂。辅料为甘露醇、右旋糖酐40、磷酸氢二钠、磷酸二氢钠。
性状本品为白色或类白色冻干块状物或粉末。
适应症1.用于不排卵(包括多囊卵巢综合征)且对枸橼酸克罗米芬治疗无效者。
2.用于辅助生殖技术超促排卵者。
规格以尿促卵泡素效价计75单位
用法用量本品可用于肌肉注射,在注射前可将粉末溶于氯化钠注射液中,为避免注射容量过大,可将本品5瓶溶于1ml的溶剂中。
1.用于不排卵(包括多囊卵巢综合征)且对枸橼酸克罗米芬治疗无效者。
本品的治疗目的是产生单个成熟的格拉夫卵泡,然后使用HCG促使卵子释放。
本品可在一个疗程内每日注射,在有月经的患者,治疗应在月经周期的头七天内开始。
应根据患者的反应来调节治疗方案。通常的治疗方案开始是每天注射FSH达75单位-150单位,如果必要的话,间隔7天或14天每天可增加或减少75单位,以获得适度的(而非过度)的反应,如果4周后治疗反应仍不佳,本周期的治疗就应停止。
如果反应适度,在最后一次注射本品后24-48小时,应单次肌注剂量10,000单位的HCG,并建议患者在应用HCG的当天或第二天过性生活。
如果反应过度,就应停止治疗并不再使用HCG,在下一周期应用较前一周期剂量为低的治疗方案。
2、用于辅助生育技术超促排卵者。
超排卵女性的治疗方案包括在月经周期的第2天或第3天开始每日应用150单位-225单位的本品,根据患者的反应调整剂量(每日最大剂量不超过450单位),继续治疗,直到获得足够的卵泡发育。
在最后一次注射本品后的24-48小时,单次注射剂量10,000单位的HCG以诱导卵泡的最终成熟。
现在已广泛应用GnRH激动剂的降调节(Down-regulation)来抑制内源性的LH峰并控制LH的水平,在通常的用药方案中,一般在激动剂治疗近两周后,开始应用本品,继续应用这两种药物,直到获得足够的卵泡发育。
举例说明,在头七天可肌注225单位的本品,根据卵巢的治疗反应调节此后的剂量。
不良反应有报道在应用FSH和HMG后可出现注射部位的局部反应,发热,关节疼痛,出现包括胃腔胀满的胃肠症状以及骨盆疼痛或乳房疼痛,轻度到中度的卵巢增大,有时可见卵巢囊肿,严重的卵巢过度刺激综合征较少见,在某些罕见的病例中发生动脉血栓栓塞,其发生与应用HMG及HCG治疗有关,在应用本品及HCG治疗中也可发生这种情况。
在少数病例应用本品治疗后可出现多胎儿,其中大部分为双胞胎,在体外受精中,这种现象与胚胎复制的数目有关。
由堕胎或流产所致的妊娠失败和由其他生育问题所致的妊娠失败的发生率类似,如果有输卵管病变的病史,则有可能发生异位妊娠。
有严重肺病(如肺不张,急性呼吸窘迫综合征)的报道。
禁忌1. 对本品以及任一成份过敏者。
2. 妊娠或哺乳期妇女。
3. 卵巢、乳腺、子宫、下丘脑或垂体肿瘤。
4. 尚未诊断明确的阴道出血。
5. 原发性卵巢功能衰竭。
6. 与多囊卵巢无关的卵巢囊肿或卵巢增大。
7. 性器官畸形不宜妊娠者。
8. 子宫纤维瘤不宜妊娠者。
注意事项1. 在治疗开始前再次确认夫妇不育的诊断,并推定是否为适应症。
2. 坚持应用所推荐的治疗剂量,并监测治疗方案以减少卵巢过度刺激症的发生,在临床验证中,严重的卵巢过度刺激症的发生率低于1%。
3. 应用本品治疗过度的卵巢反应一般不诱发明显的不良反应,除非使用HCG来诱导排卵或
已发生妊娠。卵巢过度刺激综合征通常发生在应用HCG治疗或排卵后1-2周。
4. 如果出现骨盆疼痛、腹胀等症状或卵巢增大,或雌激素测定或超声检查提示过度的雌激素反应,应中止本品的治疗,并不再接用HCG治疗,同时避免性交以防止发生卵巢的过度刺激。
5. 可能出现诸如腹水、心包渗出、胸膜积水、血液浓缩、继发性醛固酮增多症,或高凝状态等。应通过适当的医疗措施来控制这些症状,包括避免不必要的骨盆检查,如果不发生妊娠,这些症状通常在月经到来之后自行消失。
6. 对于有乳糖过敏史的患者,必须考虑到本品含有乳糖成份。
7. 废弃药品包装不应随意丢弃。
孕妇及哺乳期妇女用药孕妇与哺乳期妇女禁用。
儿童用药尚不明确。
老年用药尚不明确。
药物相互作用1. 本品与枸橼酸克罗米芬合用可增加卵泡反应。
2. 与GnRH激动剂合用时,需要增加本品的剂量以达到适当的卵泡反应。
药物过量本品使用过量可导致卵巢过度刺激综合征。
药理毒理尿促卵泡素是从绝经期妇女尿中提取纯化而来,其活性成分是FSH,FSH具有促进卵泡募集与发育的作用。对于非原发性卵巢功能衰竭的妇女,尿促卵泡素能刺激卵巢卵泡发育。在缺少内源性LH峰的情况下,当监测结果显示卵泡已充分发育时,注射本品后应注射人绒毛膜促性腺激素(HCG),以促进卵泡充分发育成熟和排卵。
药代动力学国外同品种研究报道:对内源性FSH受到抑制的自愿受试健康妇女,单剂量(225单位)和多剂量(150单位×7天)注射Bravelle,从FSH Cmax和AUC的稳态比率可以看出,皮下注射和肌肉注射Bravelle并不生物等效。多剂量肌肉注射Bravelle,Cmax 和AUC的稳态比率为77.7%,而皮下注射为81.8%。
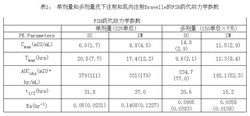
吸收:单剂量皮下和肌肉注射Bravelle,FSH血浆浓度达到最大的时间分别为20.5小时和17.4小时,但多剂量注射Bravelle,均约为10小时。
清除:单剂量皮下和肌肉注射Bravelle的平均半衰期分别为31.8小时和37小时,但其多剂量(7天)注射Bravelle分别为20.6小时和15.2小时。
贮藏遮光、密闭,阴凉处(不超过20℃)保存。
包装包装材料:注射剂瓶+药用卤化丁基橡胶塞;安瓿。
包装规格:(1)每小盒1瓶(附2ml氯化钠注射液)。
(2)每小盒2瓶。
(3)每小盒10瓶。
有效期暂定24个月
执行标准国家食品药品监督管理局标准YBH312320051




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国