门冬胰岛素30注射液,适应症为用于治疗糖尿病。成份
本品主要成份及其化学名称为:本品含30%可溶性门冬胰岛素和70%精蛋白门冬胰岛素,100U/ml,其活性成分为门冬胰岛素(通过基因重组技术,利用酵母生产的)。1U(单位)相当于6nmol,0.035mg不含盐的无水门冬胰岛素。
其它成份:甘露醇、苯酚、间甲酚、锌(氯化物)、氯化钠、二水合磷酸氢二钠、硫酸鱼精蛋白、氢氧化钠、盐酸和注射用水。
性状本品为白色或类白色的混悬液,振荡后应能均匀分散,在显微镜下观察,绝大多数晶体的长度应为1-20μm,晶体宽度不得过3μm。
适应症用于治疗糖尿病。
规格100单位/毫升,3毫升/支(笔芯)。
用法用量本品的用量因人而异,应由医生根据患者的病情来决定。本品比双时相(预混)人胰岛素起效更快,所以一般须紧邻餐前注射。必要时,可在餐后立即给药。
胰岛素需求量通常为每天每公斤体重0.5-1.0单位,可全部或部分来自本品。对有胰岛素抵抗的患者(如:肥胖原因),其每日需要量可能更高;对仍有残余内源性胰岛素分泌的患者,其每日需要量可更少。
本品经皮下注射,部位可选择大腿或腹壁。如方便,也可选择臀部或三角肌区域。注射点应在同一注射区域内轮换。像所有胰岛素一样,剂量、注射部位、血流、温度及运动量均会影响其作用时间。关于不同注射部位对本品吸收的影响尚未研究。
单独使用二甲双胍不足以控制血糖的2型糖尿病患者,本品也可以作为单一疗法。
肾功能或肝功能不全时,通常患者对胰岛素的需要量会减少。
本品尚未在18岁以下的儿童和青少年中进行研究。
本品绝不能经静脉给药。
使用、操作和处理说明
本品包装盒内的说明书中包括本品的使用和操作说明。应向患者强调本品在使用前应立刻重新混匀的重要性。重新混匀后的药液必须呈现均匀的白色雾状。
本品使用注意事项
本品应与诺和诺德胰岛素注射系统和诺和针OR配合使用。
如患者同时接受本品和另一个胰岛素笔芯治疗,应分别使用两个胰岛素注射系统,每个注射系统分别用于注射不同种类的胰岛素。
本品仅供一人专用。
本品不可重新灌装使用。
使用本品前
▲检查标签并确定其中装有正确类型的胰岛素。
▲使用前请检查本品,包括橡皮活塞。如果笔芯已被损坏。或者未使用过的笔芯的橡皮活塞与白色条码带分离,即两者之间出现间隙,请不要使用本品。井请到供应商处更换。更详细的指导信息见胰岛素注射系统使用手册。
▲使用医用酒精棉签给橡皮膜消毒。
不得使用本品的情况:
▲本品不可用于胰岛素泵。
▲如果本品或装有本品的器械发生坠落、损坏或挤压,可能会有胰岛素外漏的危险。
▲如果本品贮藏不当或被冷冻。
▲如果本品经混匀操作后不呈均匀的白色雾状。
▲如果笔芯内出现块状物,或有呈霜冻状的白色固体颗粒粘在笔芯底部或瓶壁上。
胰岛素的混匀
当笔芯尚未装入胰岛素注射系统时:
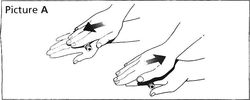
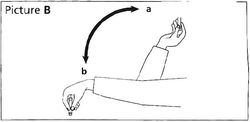
▲第一次使用本品前:将笔芯在手掌间滚搓10次,注意保持笔芯水平(见图A)。将笔芯在a和b位置之间上下摇动10次(见图B),以使笔芯内的玻璃球由一端移动到另一端。重复上述滚搓和摇动动作直至药液呈均匀的白色雾状为止。胰岛素达到室温时更易混匀。摇匀后应立即注射。
▲此后的每次注射:将装有笔芯的注射系统在a和b位置之间上下摇动至少10次(见图B),直至药液呈均匀的白色雾状为止。
请检查笔芯中至少剩余12个单位的胰岛素,以保证充分混匀。如果剩余量少于12个单位,请更换新笔芯。
本品用于皮下注射。
本品绝不能直接静脉或者肌肉注射。
为避免形成肿块,应在注射区域内轮换注射点。最佳注射部位为:腰的前部(腹壁);臀部;大腿前侧或上臂。腹壁给药起效更快。
如何注射本品
▲本品皮下注射。患者应采用医生或糖屎病专业护士的指导以及胰岛素注射系统用户手册中描述的注射技巧进行注射。
▲注射后针头应在皮下停留至少6秒,以确保全部注射入体内。
▲每次注射后都应卸下针头,否则当温度变化时会有药液从针头漏出,可能导致胰岛素的浓度发生改变。
不良反应患者使用本品时发生的不良反应主要与剂量相关,且与胰岛素药理学作用有关。与其他胰岛素制剂相同,低血糖是本品治疗中最常见的不良反应。如果胰岛素使用剂量远高于需要量,就可能发生低血糖。
严重的低血糖可能导致意识丧失和/或惊厥以及暂时性或永久性脑损伤甚至死亡。
临床试验和上市后的经验表明,低血糖发生的频率随患者的人群和用法用量的不同而变化,因此无法呈现低血糖发生的确切频率。
在临床试验期间,本品与人胰岛素相比,低血糖的总体发生率没有差异。
总结临床试验中不良反应发生的频率,经过总体判断认为和本品有关的不良反应如下所列。不良反应发生的频率定义如下:少见不良反应(大于1/1,000,小于1/100)和罕见不良反应(大于1/10,000,小于1/10,000)。个别不良反应病例定义为非常罕见不良反应(小于1/10,000)。
免疫系统异常
荨麻疹、皮疹、出疹-少见不良反应
过敏反应-非常罕见不良反应
全身性过敏反应的症状可能包括全身性皮疹、瘙痒、出汗、胃肠道不适、血管神经性水肿、呼吸困难、心悸和血压下降。
全身性过敏反应有可能危及生命。
神经系统异常
周围神经系统病变-罕见不良反应
快速改善血糖水平控制可能发生急性痛性神经病变,这种症状通常是可逆的。
视觉异常
屈光不正-少见不良反应
胰岛素治疗的初始阶段,可能会出现屈光不正。这种现象通常为一过性的。
糖尿病视网膜病变-少见不良反应
长期血糖控制良好可降低患糖尿病视网膜病变的风险。但是因强化胰岛素治疗而突然改善血糖水平控制可能发生暂时性的糖尿病视网膜病变恶化。
皮肤和皮下组织异常
脂肪代谢障碍-少见不良反应
注射部位可能会发生脂肪代谢障碍。这一情况通常是因为未在注射区域内轮换注射点所致。
局部超敏反应-少见不良反应
在胰岛素治疗期,可能发生注射点局部的超敏反应(如红、肿和瘙痒)。上述反应通常为暂时性的,在继续治疗的过程中会自行消失。
全身不适和注射部位异常
水肿-少见不良反应
胰岛素治疗的初期有可能出现水肿现象,这种现象通常为-过性的。
禁忌以下患者禁用:
1、低血糖症。
2、对门冬胰岛素或本品中任何成份过敏者。
注意事项本品注射剂量不足或治疗中断时,特别是在胰岛素依赖的糖尿病患者中,可能导致高血糖和糖尿病酮症酸中毒,这可能是致命的。
血糖控制有显著改善的患者(如接受胰岛素强化治疗的患者),其低血糖症的先兆症状会有所改变,应提醒患者注意。
本品的注射时间应与进餐时间紧密相连,即紧邻餐前。本品起效迅速,所以必须同时考虑患者的合并症及合并用药是否延迟食物的吸收。
伴有其他疾病,尤其是感染,通常患者的胰岛素需要量会增加。
患者换用不同类型的胰岛素制剂时,与先前使用的胰岛素相比,低血糖的早期先兆症状可能会有所改变或不太显著。
患者换用不同品牌和类型的胰岛素制剂的过程,必须在严密的医疗监控下进行。以下方面的变化均可能导致剂量改变:胰岛素规格、品牌、类型、种类(动物、人胰岛素或胰岛素类似物)和/或生产工艺。患者从其它胰岛素转用本品后,可能需要改变原来的剂量。如果需要调整剂量,则可以在首次给药时,或者在开始治疗的几周或几个月内进行调整。
漏餐或进行无计划、高强度的体力活动,可能导致低血糖症。
与双时相(预混)人胰岛素相比,本品在注射后6小时内有更为显著的降血糖作用。这可能需要根据患者个人情况,通过调整胰岛素剂量和/或进食补偿。
当患者增加体力活动或改变日常饮食时,需调整胰岛素剂量。餐后立即运动会增加低血糖的危险。胰岛素混悬液不可用于胰岛素泵。
运动员慎用。
对驾驶和机械操作能力的影响
低血糖症可能会损伤患者的注意力和反应能力。这些能力受损,会造成危险(如在驾驶汽车和操作机械的过程中)。
应特别提醒患者注意避免在驾驶时出现低血糖反应,尤其是低血糖先兆症状不明显或缺乏及以往经常发生低血糖症的患者。在上述情况下,应首先考虑患者能否安全操作。
孕妇及哺乳期妇女用药本品用于妊娠妇女的临床经验还有限。
动物试验没有发现门冬胰岛素与人胰岛素在胚胎毒性与致畸性方面有任何差异。
建议患有糖尿病的妊娠妇女在整个妊娠期间和计划妊娠时采用强化血糖控制和监测的方式治疗。胰岛素的需要量在妊娠早期通常减少;而在妊娠中、晚期逐渐增加。分娩后胰岛素的需要量迅速恢复到妊娠前的水平。
哺乳期妇女使用本品不受限制。哺乳母亲使用胰岛素不会对婴儿产生危害。但是本品的剂量可能需要做相应的调整。
儿童用药本品还没有在18岁以下的儿童中进行研究。请遵医嘱。
老年用药请遵医嘱。
药物相互作用已知有许多药物会影响糖代谢。
可能会减少胰岛素需要量的药物:
口服降糖药(OHAs),奥曲肽,单胺氧化酶(MAO)抑制剂,非选择性β-肾上腺素阻滞剂,血管紧张素转换酶(ACE)抑制剂,水杨酸盐,乙醇,合成代谢类固醇和硫胺类制剂。
可能会增加胰岛素需要量的药物:
口服避孕药,噻嗪类利尿剂,糖皮质激素,甲状腺激素,交感神经兴奋剂和丹那唑。β-阻滞剂可掩盖低血糖的症状。酒精可以加剧和延长胰岛素的低血糖。
配伍禁忌:
本品不能用于静脉输液。
药物过量对于胰岛素药物过量没有特别的定义。但是,胰岛素过量时会发生不同程度的低血糖反应:
A对于轻度低血糖反应可采取口服葡萄糖或含糖食物的治疗方式。所以,建议糖尿病患者随身携带糖块、糖果、饼干、或含糖的果汁。
B 对于严重的低血糖反应,在患者已丧失意识的情况之下,可由受过专业训练的人员给患者肌肉或皮下注射胰高血糖素(0.5-1.0mg),或由医务人员给予葡萄糖静脉注射。如果患者在10-15分钟之内对胰高血糖素无反应,则必须立即给予葡萄糖静脉注射。患者神志恢复之后,建议口服碳水化合物以免复发。
药理毒理药物治疗学分组:抗糖尿病药物,ATC代码,A10AD05。本品为门冬胰岛素(速效人胰岛素类似物)和精蛋白门冬胰岛素(中效人胰岛素类似物)组成的双时相混悬液。
胰岛素的降血糖作用是通过其分子与肌肉和肪细胞上的胰岛素受体结合后,促进细胞对葡萄糖吸收利用,同时抑制肝脏葡萄糖的输出来实现的。
本品是一种双时相(预混)人胰岛素类似物,它含有30%可溶性门冬胰岛素,与可溶性人胰岛素相比,这部分门冬胰岛素能迅速起效,因此可以在更接近用餐时(餐前0-10分钟)给药。结晶相(占70%)为精蛋白门冬胰岛素,其作用特点类似于人NPH胰岛素。
本品皮下注射后,将在10-20分钟内起效。作用最强时间在注射后1-4小时之间。作用持续时间可达24小时。
一项在1型和2型糖尿病患者中进行的为期3个月的临床试验结果显示:本品在糖化血红蛋白控制方面与双时相(预混)人胰岛素30R的效果相同。在摩尔当量的基础上,门冬胰岛素与人胰岛素等效价。
在一项临床研究中,341位2型糖尿病患者随机分组,单独使用本品治疗,或者使用本品与二甲双胍联合治疗,或者使用二甲双胍与磺脲类联合治疗。治疗16周后,使用本品与二甲双胍联合治疗的患者和使用二甲双胍与磺脲类药物联合治疗的患者相比,主要疗效指标糖化血红蛋白没有差异。这项临床研究中,57%的患者基线糖化血红蛋白在9%以上,在这部分患者当中,使用本品与二甲双胍联合治疗的患者比使用二甲双胍与磺脲类联合治疗的患者糖化血红蛋白下降更为显著。
临床前安全性资料
在体外试验中,包括与胰岛素和胰岛素样生长因子-1(IGF-1)受体的结合,以及对细胞生长的影响,门冬胰岛素的表现与人胰岛素非常相似。研究也表明,门冬胰岛素和胰岛素受体的解离与人胰岛素是相等的。1个月和12个月的急性毒性研究未见本品有与临床相关的毒性。
药代动力学本品是一种双时相(预混)人胰岛素。它含有30%可溶性门冬胰岛素,与常规可溶性人胰岛素相比,这部分门冬胰岛素能迅速起效,因此可以在更接近用餐时(餐前0-10分钟)给药;另外70%为精蛋白门冬胰岛素,其作用特点类似于中效人胰岛素。本品皮下注射后,将在10-20分钟内起效,作用最强时间在注射后1-4小时之间,作用持续时间可达24小时。
一项1型和2型糖尿病的为期3个月的临床试验结果显示:本品在糖化血红蛋白控制方面与双时相(预混)人胰岛素30R的效果相同。在药物用量上,门冬胰岛素与人胰岛素均等。
本品的最大血清胰岛素浓度比双时相(预混)人胰岛素30R平均高50%。本品达到最大浓度的时间平均是双时相(预混)人胰岛素30R的一半。在健康人中,经皮下注射本品每公斤体重0.20单位,约在注射60分钟后,达到最大血胰岛素浓度,平均为140±32pmol/l。本品的半衰期平均为8-9小时,反映鱼精蛋白结合部分的吸收率。血清胰岛素水平在皮下注射后15-18小时回到基值。对于2型糖尿病患者,给予本品后,血胰岛素浓度达到最大的时间约为95分钟,并将在基础水平以上保持14小时以上。目前还没有在老年、儿童及肝肾损害的患者中进行本品的药代动力学研究。
贮藏避免儿童触及。
本品应冷藏于2-8C的冰箱中,不可冷冻。
正在使用的本品不要放于冰箱中,开始使用后,可在室温下(不超过30℃)存放4周,4周之后必须丢弃。不要再存放于冰箱,不要在30℃以上保存。将本品放在包装盒中以避免光照。
如果本品振摇后不呈均匀的白色雾状混悬液,请勿使用。
不使用时盖上笔帽,避光保存。
包装盒上标明了有效期,切勿使用过期药品。
注意每次注射后必须卸下针头,否则,当温度变化时就会有药液从针头漏出。
包装笔芯由1型玻璃制成,一端使用橡胶活塞密封,另一端使用不含乳胶的橡胶膜密封,装有3ml混悬液。笔芯内含有玻璃球以帮助混匀胰岛素。每盒1支。
有效期24个月。
执行标准进口药品注册标准JS20090016




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国