艾塞那肽注射液,用于改善2型糖尿病患者的血糖控制,适用于单用二甲双胍、磺酰脲类.以及二甲双胍合用磺酰脲类,血糖仍控制不佳的患者。
成份本品主要成份为艾塞那肽。
化学结构式:

分子式:C184H282N50O60S
分子量:4186.6
辅料:甘露醇、醋酸钠三水合物、间甲酚、冰醋酸、注射用水
性状本品为无色澄明液体。
适应症本品用于改善2型糖尿病患者的血糖控制,适用于单用二甲双胍、磺酰脲类.以及二甲双胍合用磺酰脲类,血糖仍控制不佳的患者。
规格(1)5 μg剂量刻度注射笔:0.25 mg/m1,1.2 m1/支,单次注射药量5 μg,内含60次注射的药量。
(2)10 μg剂量刻度注射笔:0.25 mg/m1,2.4 m1/支,单次注射药量10 μg.内含60次注射的药量
用法用量本品的起始剂量为每次5微克(μg),每日二次,在早餐和晚餐前60分钟内(或每天的2顿主餐前;给药间隔大约6小时或更长)皮下注射。不应在餐后注射本品。根据临床应答,在治疗1个月后剂量可增加至每次10微克,每日二次。每次给药应在人腿、腹部或上臂皮下注射。
本品推荐用于接受二甲双胍、一种磺酰脲类、二甲双胍合用一种磺酰脲类治疗,血糖仍控制不佳的2型糖尿病患者。在二甲双胍治疗的基础上加用本品时,可继续使用二甲双胍的目前剂量,因为合用本品发生低血糖而需要调整二甲双胍剂量的可能性较低。在磺酰脲类治疗基础上加用本品时,应该考虑降低磺酰脲类的剂量,以降低低血糖发生的风险(参见【注意事项】,低血糖)。
本品为无色澄明液体,当溶液有颗粒、浑浊或变色时不得使用。过有效期后不得使用。
尚无本品静脉或肌肉注射的安全性和有效性资料。
注射笔使用指南
注射笔的详细操作图示和注射指导请参见本品包装盒中所附“注射笔使用手册”。
重要提示
使用本注射笔前请仔细阅读“注射笔使用手册”,如果不完全按照使用手册操作可能会出现剂量错误、注射笔损坏或者发生感染。
·每次使用前请检查注射笔上的标签,确认其为自已所用的5 μg或10 μg注射笔。
·每支新笔第一次使用之前,必须按照新笔设置的要求进行设置,此设置仅在新笔第一次使用前进行。
·如果注射笔有任何部分的破裂或损坏,则不得使用。
·不推荐盲人或视力损伤者使用本注射笔。如需使用应在接受过本品培训的人的帮助下使用。
·不得将此百泌达注射笔中的药液转移到其他注射器或药瓶中使用。
·确认本品笔芯中的药液是澄明、无色且无颗粒物。如果不是,则不得使用。
·请按照医务人员推荐的无菌注射技术进行操作。
·注射笔从第1次设定后最多可用30天。首次使用至30天后,既使注射笔内尚余药液,也应丢弃。当开始使用艾塞那肽注射笔时,请将第1次使用的日期和30天后的日期记录在使用手册的空白处。
注射笔特点
·预装注射笔内含有60次皮下注射的药量,可供30天使用。
·对5 μg注射笔每次注射剂量固定为5微克,对10 μg注射笔每次注射剂量固定为10微克。
针头
·本品包装盒内无注射笔针头。注射笔可使用:
-29(细)、30或31(更细)号规格的一次性针头。
请询问医生何种型号和长度的针头适合您使用。
·每次注射都使用新针头。每次注射完成后均应移除针头以防艾塞那肽注射液泄漏,也可防止产生气泡、减少针头堵塞而将感染的风险减到最低。
·不得与他人共用你的注射笔或针头。
·使用前一定要确认针头牢固地安装在注射笔上。针头未安装好之前不得按注射按钮。
·将用过的针头弃于放锐器用的容器中或按医生的要求妥善处置。不得将注射笔在带有针头时丢弃。
·医生及医务工作者应按当地要求或管理规定处理注射针头。
清洁
·如果需要,可以用一块干净、潮湿的布擦拭注射笔的表面。
·在正常使用过程中,注射笔芯顶部的外侧可能会出现一些白色的颗粒。可以用酒精纱布或酒精棉签擦去。)
不良反应临床研究数据
与二甲双胍、一种磺酰脲类或二者合用
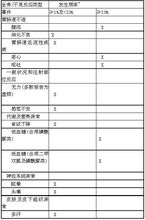
*数据来源于3项30周安慰剂对照临床试验(艾塞那肽组N=963)
艾塞那肽与一种磺酰脲类合用,或艾塞那肽与二甲双胍及一种磺酰脲类合用,与对照组(安慰剂合用磺酰脲,或安慰剂合用一种磺酰脲及二甲双胍)相比低血糖的发生率增加,并表现出与艾塞那肽和磺酰脲类呈剂量依赖性。大多数低血糖的程度为轻到中度,可通过口服碳水化合物缓解。(见【注意事项】)
为减少与磺酰脲类合用时发生低血糖的风险,应考虑降低磺酰脲类药物的原有剂量(见【用法用量】)
然而,本品与二甲双胍合用时,相对于安慰剂合用二甲双胍对照组,低血糖的发生率并未升高。
报告的最常见的不良反应为具有剂量依赖性的轻到中度恶心。大多数治疗开始时出现恶心的患者,症状的发生频度和严重程度会随着继续治疗时间的延长而减轻。
在30周安慰剂对照研究中,患者因不良事件退出临床试验的发生率在艾塞那肽治疗组为7%,而在安慰剂组为3%。导致艾塞那肽治疗组患者退出试验的最常见不良事件为恶心(占3%)和呕吐(占1%):在安慰剂组,




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国