注射用重组人凝血因子Ⅷ,本品用于血浆凝血因子Ⅷ(FⅧ)缺乏的甲型血友病治疗。在纠正或预防出血、急诊或择期手术中,本品起到暂时代替缺失的凝血因子的作用。
成份本品主要成份为重组人凝血因子Ⅷ。
本品加入了蔗糖(0.9-1.3%)、甘氨酸(21-25mg/ml)和组氨酸(18-23mM)。产品中还含有氯化钙(2-3mM)、钠(27-36mEq/L)、氯(32-40mEq/L)、聚山梨酯80(≤64-96µg/ml)、咪唑(≤20µg/1000IU)、磷酸三丁酯(≤5µg/1000IU)和铜(≤0.6µg/1000IU)。
性状白色或浅黄色干粉剂。
适应症本品用于血浆凝血因子Ⅷ(FⅧ)缺乏的甲型血友病治疗。在纠正或预防出血、急诊或择期手术中,本品起到暂时代替缺失的凝血因子的作用1。
规格250 IU/瓶,500 IU/瓶,1000 IU/瓶
用法用量在瓶签上本品用国际单位标示rFⅧ(重组人凝血因子Ⅷ)的效价,其效价用一期法测定。复溶后的药物必须在药物溶解后3小时内注射完毕。建议使用包装内提供的静脉注射用器具。
一般性治疗方法和疗效评估
下述剂量提供了一般性指导原则。须强调的是不同患者达到止血所需要的本品剂量各不相同,应视患者的需要、FⅧ缺乏的严重程度、出血的严重程度、抗体存在的情况和期望达到的FⅧ水平而定。治疗时监控患者的FⅧ尤为重要。FⅧ水平为疗效评估的重要因素。为达到满意疗效,必要时使用剂量可高于计算值。如果按公式计算的剂量注射后未达到预期的FⅧ水平,或出血未得到控制,应怀疑患者体内是否存在抗体。通过实验室检查可检测和定量抗体。存在抗体时,不同患者所需的FⅧ剂量差异较大,可根据疗效优化治疗方案。某些低抗体滴度([10BU)的患者应用FⅧ制剂成功治疗后,并未产生免疫记忆应答抗体滴度升高。通过评估FⅧ的水平和临床疗效进行适宜治疗。对FⅧ产生记忆应答或具有高滴度抗体的患者,必要时可选择其他治疗药物,如凝血因子IX复合物制剂、抗血友病因子(猪源性)、重组激活凝血因子Ⅶa或抗抑制剂凝血因子复合物。
剂量计算
体内FⅧ水平升高的百分比可用每公斤体重注射本品的剂量(IU/kg)乘以每公斤体重每个单位的2%(2%/IU/kg)计算而得。计算方法依据血浆FⅧ和重组AHF在临床使用的剂量,下面举例说明:
预计的FVIII升高值(%)=#注射单位*2%/IU/kg/体重
70kg的成年人:1400IU*2%、/IU/kg/70kg
或者
需要的剂量(IU)=体重(kg)*预计的FVIII升高值/(2%/IU/kg)
15kg的儿童:15kg*100%/(2%/IU/kg)=750IU
参照下述指导原则,根据出血的类型和严重程度计算到达止血所需要的注射剂量。
参照下述指导原则,根据出血的类型和严重程度计算到达止血所需要的注射剂量。
轻微出血(表层出血、早期出血、出血到关节)-治疗所需的血浆活性FVIII水平为20-40%:维持治疗血浆中水平的必要剂量为10-20IU/kg,如进一步出血,按上述剂量再次注射;
中等出血(肌肉、口腔、关节出血和外伤、小手术)-治疗所需的血浆活性FVIII水平为30-60%:维持治疗血浆中水平的必要剂量为15-30IU/kg,必要时,在12-24小时之间再按上述剂量注射1次;
危及到生命的出血(颅内、腹内或胸廓内出血、胃肠出血、中枢神经系统出血、咽后或腹膜后或髂腰肌膜出血)骨折颅部外伤-治疗所需的血浆活性FVIII水平为80-100%:维持治疗血浆中水平的必要剂量为开始给予40-50IU/kg,每8-12小时按20-25IU/kg注射1次;
手术(较大的外科手术)-治疗所需的血浆活性FVIII水平大约为100%:维持治疗血浆中水平的必要剂量为术前给予50IU/kg,并确定FVIII活性100%,必要时,开始注射6-12小时后,按上述剂量重复注射持续10-14天,直至痊愈。
预防
正如Nilsson 等人报道,AHF(抗血友病因子)浓缩剂定期注射可预防出血。
使用说明
本品复溶、注射和静脉注射用器具及针头的处理必须小心谨慎。经皮注射的针头如被血液污染可传染病毒包括HIV(AIDS)和肝炎。一旦发生损伤,应立即观察。一次性使用的针头用完后放入保护套中。静脉注射用的全部器具包括复溶后的本品均应废弃,按生物安全程序进行处理。
复溶
操作前须清洗双手。
除去真空
1.未开盖的稀释液和浓缩剂进行加温,温度不能超过37℃,99°F。
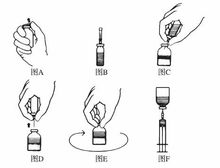
2.分别除去塑料顶盖后(图A),酒精消毒橡胶塞。注意:千万不要打开橡胶塞。
3.去除双向针头一端的保护套,将针头刺入稀释液瓶的橡胶塞(图B)。
4.去除双向针头另一端的保护套,倒转稀释液瓶后,针头以一定的角度刺入浓缩剂瓶的橡胶塞(图C)。
5.浓缩剂瓶中的真空会把稀释液抽吸到瓶中。稀释液瓶以一定的角度对准浓缩剂瓶,以便稀释液直接射入到浓缩剂的瓶壁上(图C)。避免产生过多的气泡。如稀释液未抽吸到浓缩剂瓶中,说明瓶中真空不足,该瓶浓缩剂不能使用。
6.移去稀释液瓶和双向针头后(图D)轻摇,直到浓缩剂完全溶解,避免产生过多的气泡(图E)。
7.用酒精再次消毒复溶后的本品橡胶塞,在空气中自然干燥。
8.浓缩剂粉末全部溶解后,用包装中提供的带过滤针头的注射器把溶液吸入到注射器中(图F)。再用提供的静脉注射用器具替换过滤针头,进行静脉注射。注意:进行静脉穿刺应紧紧抓住一个翼或二个翼;此时不能使用针头护套。
9.如果同一患者注射量超过1瓶,在连接静脉注射针头之前,需分别用未使用过的一次性过滤针头将两瓶溶液抽吸入同一注射器中。
10.注射用溶液及容器在使用前须肉眼检查有无颗粒物质和颜色变化。
注射速度
注射速度应根据每个患者的反应,5-10分钟或更短时间注射完,患者的耐受性良好。
内容物
本品一次使用的包装含有以下内容物:适量的灭菌注射用水,灭菌的双向针头、灭菌的过滤针头和静脉注射用器具。

不良反应对曾接受治疗的患者(PTPs)进行了临床研究,注射4160次发生不良反应109例(占2.6%)。13例与药物至少有间接关系,另7例无法评估。因此在11个患者中发生的20 例不良反应或无法评估,或至少与本品有间接关系,仅0.5%的不良反应与注射的药物有关系。与药物有间接关系的不良反应包括注射部位的局部反应(2例)、头晕(2例)、出疹(2例)、味觉改变(1例)、血压升高(1例)、瘙痒(1例)、人格解体(1例)、恶心(1例)和鼻炎(1例)。72名(PTPs)严重甲型血友病患者曾接受本品平均治疗54 天,未产生FⅧ抗体。
未曾接受治疗的患者(PUPs)和少量接受过治疗(MTP)的患儿临床研究中,18 例不良反应至少可能与药物有关,其中8名患者因产生抗体而引发的并发症(前述临床药理部分的10名患者包括这8名患者):静脉穿刺前臂出血、便秘、腺病、出疹,1名患者出现贫血、面色苍白、胃肠炎和严重中耳炎。
上市后经验
下列不良反应主要来自于上市后经验和发表的文献,一般无法估计其准确的比例。接受前一代产品治疗的患者,尤其是年幼患者或以前接受过其他FⅧ浓缩剂的患者,发生严重的变态反应和过敏反应病例非常罕见。个别患者会产生低血压。报道出现风疹也十分罕见。本品以蔗糖作配方,虽未报道这些严重的不良反应,但也可能会发生。曾有报道使用本品会产生呼吸困难的不良反应。
禁忌对该产品不耐受或有过敏反应者
对鼠或仓鼠蛋白过敏者
注意事项本品用于治疗FⅧ缺乏的出血障碍。注射本品之前,应确诊患者FⅧ缺乏。
甲型血友病患者接受治疗后,可能会产生FⅧ的中和抗体,尤其是严重的血友病患儿在治疗的第一年内,或曾用少量FⅧ治疗的任何年龄患者,产生抗体的情况尤为常见。甲型血友病患者在治疗的任何时间都有可能产生抗体。根据血友病治疗中心的建议,对接受任何FⅧ浓缩剂治疗的患者,包括本品,须通过临床观察和实验室检测密切监控患者FⅧ抗体产生的情况。
文献报道应用抗血友病因子浓缩剂治疗患者中,可产生下述症状:低血压、风疹、胸部压迫感伴过敏反应。也有报道应用前一代产品KOGENATE发生变态和过敏反应,但非常罕见,主要发生在儿童和曾接受过其他FⅧ浓缩剂治疗的患者中(详见不良反应-上市后经验)。严重的过敏反应须采取紧急抢救措施如注射肾上腺素和吸氧。
产生鼠或仓鼠蛋白的抗体
临床研究中观察了患者是否对鼠或仓鼠蛋白产生血清学反应。结果表明未发现患者对这些蛋白产生特异性抗体,注射本品也未发现对动物蛋白的严重过敏反应。虽然未曾观察到这些过敏反应,但应意识到患者可能对鼠或仓鼠蛋白的过敏,应警惕过敏反应的早期症状(如荨麻疹、局部或全身风疹、哮喘和低血压)。如果发现这些症状,建议患者停止使用该产品,并应及时和医生联络。
本品不含血管性假性血友病因子(von Willebrands factor),故不能用于血管性假性血友病的治疗。
孕妇及哺乳期妇女用药未曾应用本品进行动物繁殖的研究。孕妇使用本品是否会引起胎儿损伤或影响生殖能力尚未明确。只有必需时,本品才能在妊娠和哺乳期应用。
儿童用药对未接受过和接受过少量本品的患儿(n=62)已进行了安全性和有效性的研究。本品适用所有年龄的儿童,包括新生儿、婴儿、儿童和青少年。
老年用药本品的临床研究中,由于65 岁或65 岁以上的患者例数不足,所以不能确定老年患者与年轻患者是否存在不同反应。然而根据KOGENATE®和其他AHF 产品的临床经验。老年和年轻患者之间并无差异。对接受本品的老年患者,根据每个人的情况而选择剂量。
药物相互作用目前尚未发现和其他药物存在药物相互作用。
药物过量目前尚无药物过量的报道。如怀疑药物过量,密切注意不良反应并采取适当的措施。
临床试验在北美和欧洲,71 名严重甲型血友病患者参加了为期个6月的应用本品进行家庭治疗的研究,这些患者年龄为12-59 岁,曾接受过其他重组FⅧ和血浆抗血友病因子的治疗。该研究中共进行3995 次静脉注射,共计7,400,000 单位本品。研究期间治疗659 次出血,共注射951 次本品。多数情况下(89.5%)通过一次或两次注射就能成功止血,每次平均使用剂量约28IU/kg。定期注射治疗占76%。有9名患者在11 次手术中应用本品治疗,这些手术包括1例脑瘤切除术、2例膝盖置换术、2例关节滑膜切除术(其中1例伴跟腱拉长)、2例包皮环切术、3例疝气修补术和3例拔牙。所有病例显示了满意的止血效果。
临床研究中,本品被应用在未曾接受过治疗的出血患者(PUPs)和接受过少量治疗的儿童出血病例中(MTPs)。61 例PUPs/MTPs 接受本品的治疗。通过一次或两次静脉注射本品就能有效止血。其中10 名患者产生了抗体,占15%。该研究中,约一半的患者治疗期在20 天以上,产生抗体的情况与其他患儿使用血浆FⅧ和重组FⅧ时是一致的。
药理毒理药理作用
本品采用重组DNA 技术生产,其生物学活性与从血浆中提纯的FⅧ相同,用于治疗传统的血友病(甲型血友病)。
毒性研究
致癌、致突变和对生殖能力的损伤
对超剂量(远大于临床使用最高剂量)rFⅧ的潜在致突变性进行了体外评价,未发现逆转突变和染色体畸变。对动物使用rFⅧ进行了体内评价,其剂量是临床最高剂量的10-40 倍,亦证明rFⅧ不存在潜在的致突变作用。rFⅧ在动物体内潜在致癌作用的长期观察未曾进行。
药代动力学在北美对20 名严重甲型血友病患者进行药代动力学研究。在与前一代产品KOGENATE®药代动力学比较研究中,本品的结果与KOGENATE®结果相似。本品注射10 分钟后,FⅧ平均恢复率为2.1±0.3%/IU/kg,KOGENATE®2.4±0.7%/IU/kg,两者无统计学差异(可信区间0.815-1.01)。本品平均生物学半衰期与KOGENATE®相似,平均为13小时,与从血浆中提纯的抗血友病因子(AHF)半衰期相似。rFⅧ和本品都能缩短活化部分凝血活酶时间。本品恢复率和半衰期在治疗的24周内没有改变,表明持续有效,无证据表明产生了FⅧ抑制物。37 例患者(用本品治疗24 周后),一次注射本品10分钟后,FⅧ平均恢复率为2.1%/IU/kg,与基线、治疗第周和12周平均恢复率无显著改变。
贮藏本品需冷藏(2-8℃;36-46℉)。该产品在有效期之前在室温下(不超过25℃,77℉)可保存3个月。禁止冷冻。有效期后禁止使用。使用前应避光保存于包装盒内。
包装1瓶注射用重组人凝血因子Ⅷ
2.5ml 灭菌注射用水
1支灭菌双向针头
1支灭菌过滤针头
1套灭菌的静脉注射组
有效期24 个月
执行标准进口药品注册标准JS20050025
妊娠分级FDA妊娠分级:C




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国