盐酸拓扑替康胶囊,用于一线化疗失败的广泛期小细胞肺癌患者。采用盐酸拓扑替康+顺铂二线治疗,但尚缺乏数据支持本品可替代广泛期小细胞肺癌的一线治疗标准方案。
成份本品主要成份为盐酸拓扑替康,化学名称:(S)-10-[(二甲胺基)甲基]-4-乙基-4,9-二羟基-1H-吡喃并[3',4':6,刁吲嗪并[1,2-b]-喹啉-3,14-(4H,12H)-二酮盐酸盐
化学结构式:
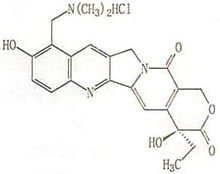
分子式:C23H23N3O5·HCl
z分子量:457.9
性状本品为硬胶囊剂,内容物为淡黄色颗粒或粉末。
适应症对于一线化疗失败的,采用盐酸拓扑替康+顺铂二线治疗,但不能耐受静脉给药的广泛期小细胞肺癌患者,可试用本品与顺铂联合治疗。
尚缺乏数据支持本品可替代广泛期小细胞肺癌的一线治疗标准方案。
规格按拓扑替康计算(1)0.25mg(2)1mg
用法用量口服给药,与顺铂联用。推荐剂量为每日一次,每次接体表面积1.4mg/m2,连续服用5天,在第5天给予顺铂(75mg/m2)静脉输注,每21天为一个疗程。可根据患者耐受性调整本品剂量,调整原则:
1.治疗中出现3级血液学毒性,下一周期剂量可减少25%。如出现4度粒细胞减少合并严重感染性发热则中止治疗。
2.治疗中胆红素异常者推迟两周,如仍未恢复则停止用药。
3.肝功能转氨酶大于正常值2.5倍时,下一周期剂量减少25%,大于5倍时停止用药。
4.治疗中出现肾功能毒性1级,下一周期剂量减少25%,如出现2级毒性则中止治疗。
单独用药剂量尚未进行研究。
不良反应盐酸拓扑替康最常见的剂量限制性毒性反应为骨髓抑制,主要是中性粒细胞减少。口服给药和静脉给药的血液系统毒性主要有中性粒细胞减少、血小板减少和贫血,非血液学毒性主要有恶心、呕吐、脱发和腹泻。据国外口服给药和静脉给药临床研究表明,口服给药的血液学毒性Ⅲ-Ⅳ级中性粒细胞减少的发生率较静脉给药低。口服给药的非血液学毒性呕吐、腹泻、脱发可能较静脉给药多见。
1.国内研究
安全性分析数据来自于63例小细胞肺癌患者,主要观察到的不良反应如下:
血液系统毒性:在临床研究的63例病人中,82.5%的病人出现中性粒细胞减少,Ⅲ-Ⅳ级发生率为25.4%;88.9%的病人出现白细胞减少,Ⅲ-Ⅳ级发生率为12.7%;69.8%的病人出现血红蛋白减少,Ⅲ-Ⅳ级发生率为15.9%;44.4%的病人出现血小板减少,Ⅲ-Ⅳ级发生率为9.5%。
非血液学毒性主要有恶心、呕吐、脱发、便秘和腹泻。在临床研究的63例病人中,74.06%的病人出现恶心,其中Ⅲ级占6.4%;57.14%的病人出现呕吐,Ⅲ-Ⅳ级占11.11%;17.5%的病人出现Ⅰ级脱发;12.7%的病人出现Ⅰ-Ⅱ级便秘;11.1%的病人出现腹泻,其中1例(1.6%)为Ⅲ级。另有2例口腔炎、1例头晕、1例皮疹.个别病人出现肝酶升高。
2.国外研究
对389例接受口服拓扑替康/顺铂治疗的广泛期小细胞肺癌初治患者进行安全性分析,结果:血液学毒性方面,Ⅳ级中性粒细胞减少的发生率为26%,Ⅳ级血小板减少的发生率为8.7%,Ⅲ-Ⅳ级贫血的发生率为37.3%,Ⅳ级中性粒细胞减少伴随发热/感染的发生率为3.9%,脓血症的发生率为4.2%;非血液学毒性主要有Ⅲ级恶心(3.9%、Ⅲ-Ⅳ级呕吐(4.5%)、Ⅲ-Ⅳ级腹泻(5.8%)和Ⅲ-Ⅳ级厌食(3.7%)。
3.盐酸拓扑替康静脉给药观察到的不良反应
盐酸拓扑替康静脉给药时观察到的不良反应也可能会出现在口服给药途径,包括血液系统毒性有白细胞减少、血小板减少、贫血等反应,消化系统有恶心、呕吐、腹泻、便秘、肠梗阻、腹痛、口腔炎、厌食。脱发,偶见严重的皮炎及搔痒:头痛,关节痛,肌肉痛,全身痛,感觉异常,呼吸困难,乏力,不适,发热,有时出现肝功能异常,转氨酶升高,罕见过敏反应及血管神经性水肿。
禁忌1.对拓扑替康及本品其他成份有过敏史的病人禁用;
2.孕妇、哺乳期妇女禁用;
3.患有严重骨髓抑制,中性粒细胞




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国