盐酸右美托咪定注射液,用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
成份本品主要成份为盐酸右美托咪定,其化学名称为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
化学结构式:

分子式:C13H16N2·HCl
分子量:236.7
本品辅料为氯化钠。
性状本品为无色或几乎无色的澄明液体。
适应症用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
规格2ml∶200μg(按右美托咪定计)。
用法用量成人剂量:配成4μg/ml浓度以1μg/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用0.9%的氯化钠溶液稀释达浓度4μg/ml,可取出2ml本品加入48ml 0.9%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整:
由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性:
因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:0.9%的氯化钠水溶液,5%的葡萄糖水溶液。
已经证实一些类型的天然橡胶可能吸收本品,建议使用合成的或有涂层的橡胶垫给药装置。
不良反应由于临床试验是在多种不同情况下进行的,因此一种药物在临床试验中观察到的不良反应发生率不能与另一种药物进行直接比较,而且可能无法反映实际临床应用中观察到的不良反应情况。
国外研究报道使用盐酸右美托咪定注射液与以下严重不良反应有关:
·低血压、心动过缓及窦性停搏(见注意事项)
·暂时性高血压 (见注意事项)
国外研究报道与治疗相关的发生率大于2%的最常见不良反应为低血压、心动过缓及口干。
以下(包括上市后情况)为国外临床研究中发生的不良反应情况:
重症监护室(ICU)的镇静
不良反应信息来源于重症监护室的1007例患者接受持续输注盐酸右美托咪定注射液(Precedex)镇静的试验。平均总剂量为7.4μg/kg (范围: 0.8~84.1),每小时平均剂量为0.5μg/kg/hr (范围: 0.1~6.0),平均输注时间为15.9小时 (范围: 0.2~157.2)。试验人群在17至88岁之间,43%≥65岁,男性占77%,93%为高加索人。表1为发生率>2%的药物不良反应。最常见的不良反应为低血压、心动过缓及口干。
表1:发生率]2%的不良反应——重症监护室镇静的受试人群

程序镇静:
不良反应信息源自于两项程序镇静的试验,这两项试验中共有318例患者接受了盐酸右美托咪定注射液(Precedex)治疗。平均总剂量为1.6μg/kg (范围: 0.5~6.7),每小时平均剂量为1.3μg/kg/hr (范围: 0.3~6.1),平均输注时间为1.5小时 (范围: 0.1~6.2)。试验人群在18至93岁之间,30%的患者≥65岁,男性占52%,61%为高加索人。
表2为发生率]2%的药物不良反应。最常见的不良反应为低血压、心动过缓及口干。表的脚注为生命体征指标报告为不良反应的预先设定标准。两项试验中患者呼吸速率下降和缺氧的发生率在Precedex给药组和对照组均相似。
表2:发生率>2%的不良反应——程序镇静的受试人群
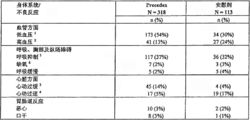
1、低血压的绝对和相对定义为:收缩压[80 mmHg 或比试验药物输注前值低30%以下,或舒张压180 mmHg或比试验药物输注前值高30%以上,或舒张压>100 mmHg。
3、心动过缓的绝对和相对定义为每分钟心跳次数120或比输注前值高30%以上。
5、呼吸抑制的绝对和相对定义为呼吸频率>每分钟8次或比基线下降了25%以上。
6、缺氧的绝对和相对定义为SpO2 65岁)受试者中右美托咪定的药代动力学无差异。
儿科患者:
右美托咪定在儿科患者的药代动力学特性未被研究。
肝功能损伤:
在不同程度肝功能损伤受试者(Child-Pugh分类A、B或C),右美托咪定的清除率值比健康受试者低。轻、中和重度肝功能损伤受试者的平均清除率值分别为正常健康受试者的74%、64%和53%,游离药物的平均清除率分别为正常健康受试者的59%、51%和32%。
尽管本品给药需达到效果,但是肝功能损伤患者或许需要考虑减少给药剂量(见用法用量、注意事项)。
肾功能损伤:
严重肾功能损伤受试者(肌酐清除率:




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国