简介热力学定义
在热力学中,熵是系统的热力学参量,它代表了系统中不可用的能量,衡量系统产生自发过程的能力。熵增加,系统的总能量不变,但其中可用部分减少。孤立系统的熵不会减少,这也是热力学第二定律的表现之一。
统计学定义在统计学中,熵衡量系统的无序性,代表了系统在给定的宏观状态(如温度、压强、体积等等)下,处于不同微观状态的可能性,或者说构成该宏观系统的微观方式的数量。举例,已知在3个盒子里有3个球,这个是系统的宏观状态,微观状态则是球在不同盒子间的分布(如3个球全部在第一个盒子,或者一个盒子里有一个球等等)。熵越高的系统就越难精确描述其微观状态。
熵定义熵,热力学中表征物质状态的参量之一,用符号S表示,其物理意义是体系混乱程度的度量。1
(1)经典热力学
1865年,克劳休斯将发现的新的状态函数命名为,用增量定义为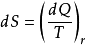 ,式中T为物质的热力学温度;dQ为熵增过程中加入物质的热量,下标“r”是英文单词“reversible‘’的缩写,表示加热过程所引起的变化过程是可逆的。
,式中T为物质的热力学温度;dQ为熵增过程中加入物质的热量,下标“r”是英文单词“reversible‘’的缩写,表示加热过程所引起的变化过程是可逆的。
若过程是不可逆的,则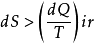 ,下标“ir”是英文单词“ireversible‘’的缩写,表示表示加热过程所引起的变化过程是不可逆的。
,下标“ir”是英文单词“ireversible‘’的缩写,表示表示加热过程所引起的变化过程是不可逆的。
合并以上两式可得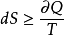 ,此式叫做克劳休斯不等式,是热力学中第二定律最普遍的表达式。
,此式叫做克劳休斯不等式,是热力学中第二定律最普遍的表达式。
(2)统计热力学
熵的大小与体系的微观状态Ω有关,即S=klnΩ,其中k为玻尔兹曼常量,k=1.3807x10-23J·K-1。体系微观状态Ω是大量质点的体系经统计规律而得到的热力学概率,因此熵有统计意义,对只有几个、几十或几百分子的体系就无所谓熵。
性质(1)状态函数
熵S是状态函数,具有加和(容量)性质,是广度量非守恒量,因为其定义式中的热量与物质的量成正比,但确定的状态有确定量。其变化量ΔS只决定于体系的始终态而与过程可逆与否无关。由于体系熵的变化值等于可逆过程热温商δQ/T之和,所以只能通过可逆过程求的体系的熵变。孤立体系的可逆变化或绝热可逆变化过程ΔS=0。2
(2)宏观量
熵是宏观量,是构成体系的大量微观离子集体表现出来的性质。它包括分子的平动、振动、转动、电子运动及核自旋运动所贡献的熵,谈论个别微观粒子的熵无意义。
(3)绝对值
熵的绝对值不能由热力学第二定律确定。可根据量热数据由第三定律确定熵的绝对值,叫规定熵或量热法。还可由分子的微观结构数据用统计热力学的方法计算出熵的绝对值,叫统计熵或光谱熵。
熵增原理熵增原理就是孤立热力学系统的熵不减少,总是增大或者不变。用来给出一个孤立系统的演化方向。说明一个孤立系统不可能朝低熵的状态发展即不会变得有序。3
系统经绝热过程由一状态达到另一状态熵值不减少——熵增原理(the principle of the increase of entropy)
对绝热过程,Q = 0 ,有ΔS(绝热)≥ 0(大于时候不可逆,等于时候可逆) 或 dS(绝热)≥0 (>0不可逆;=0可逆)
熵增原理表明,在绝热条件下,只可能发生dS≥0 的过程,其中dS = 0 表示可逆过程;dS>0表示不可逆过程,dS




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国