吉非替尼(Gefitinib,伊瑞可,易瑞沙)是一种口服表皮生长因子受体酪氨酸激酶(EGFR-TK)抑制剂(属小分子化合物)。对EGFR-TK的抑制可阻碍肿瘤的生长、转移和血管生成,并增加肿瘤细胞的凋亡。
基本信息中文名称:吉非替尼
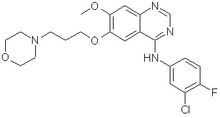
中文别名:N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉-4-丙氧基)喹唑啉-4-胺;易瑞沙(阿斯利康公司的抗肿瘤新药);吉非替尼(易瑞沙);
英文名称:Iressa / Gefitinib Tablets
英文别名:GEFITINIB; AKOS 91371; n-(3-chloro-4-fluoro-phenyl)-7-methoxy-6-(3-morpholin-4-ylpropoxy)quinazolin-4-amine; N-(3-Chloro-4-fluorophenyl)-7-methoxy-6-[3-(4-morpholinyl)propoxy]-4-quinazolinamine; ZD 1839; 4-Quinazolinamine, N-(3-chloro-4-fluorophenyl)-7-methoxy-6-[3-(4-morpholinyl)propoxy]-; Gefitinib(TINIBS); Gefitinib, Iressa, ZD1839; Gefitinib Base
 CAS号:184475-35-2
CAS号:184475-35-2
分子式:C22H24ClFN4O3
分子量:446.9024
药物性状褐色,圆形,双凸面,薄膜衣片;一面印有"IRESSA 250",另一面光滑。每瓶含吉非替尼 250mg*30s。
适应症本品适用于治疗既往接受过化学治疗的局部晚期或转移性非小细胞肺癌(NSCLC)。既往化学治疗主要是指铂剂和多西紫杉醇治疗。
本品对于既往接受过化学治疗的局部晚期或转移性非小细胞肺癌患者的疗效,是基于大规模安慰剂对照临床试验预设亚洲亚组的生存优势(注:该试验总体人群中未显示改善疾病相关症状和延长生存期)及中国非对照临床试验的生存数据而确立的。
两个大型的随机对照临床试验结果表明:吉非替尼联合含铂化疗方案一线治疗局部晚期或转移性NSCLC未显示出临床获益,所以不推荐此类联合方案。1
引发症全球因吉非替尼所致的间质性肺炎平均发病率约1%,在中国发病率更低些,只有0.5%。致死病例在日本偶有发生,在我国迄今尚未见报道。我们主张在个别已有肺纤维化、接受过大面积放疗和肺功能严重受损的病人中应慎用吉非替尼,以防止发生致命性间质性肺炎。但在相当一部分晚期肺癌病人本身合并有肺部其它疾病(肺结核病、肺气肿、支气管哮喘等),肺部易诱发感染,因此不能完全确定所有的间质性肺炎均为易瑞沙所致
禁忌已知对该活性物质或该产品任一赋形剂有严重超敏反应者
药理毒理药物动力学特性:吉非替尼是一种选择性表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,该酶通常表达于上皮来源的实体瘤。对于EGFR酪氨酸激酶活性的抑制可妨碍肿瘤的生长,转移和血管生成,并增加肿瘤细胞的凋亡。在体内,吉非替尼广泛抑制异种移植于裸鼠的人肿瘤细胞衍生系的肿瘤生长,并提高化疗、放疗及激素治疗的抗肿瘤活性。在临床实验中已证实吉非替尼对局部晚期或转移性非小细胞肺癌具客观的抗肿瘤反应并可改善疾病相关的症状。药物代谢动力学特性静脉给药后,吉非替尼迅速廓清,分布广泛,平均清除半衰期为48小时。
癌症患者口服给药后,吸收较慢,平均终末半衰期为41小时吉非替尼每天给药1次出现2-8倍蓄积,经7-10天的给药后达到稳态。24小时间隔用药,循环血浆药物浓度一般维持在2-3倍之间。吸收口服给药后,吉非替尼的血浆峰浓度出现在给药后的3到7小时。癌症患者的平均吸收生物利用度为59%。进食对吉非替尼吸收的影响不明显。在一项健康志愿者的实验中,当pH值维持在pH5以上时,吉非替尼的吸收减少47%(见4.4和4.5节)。分布在吉非替尼稳态时的平均分布容积为1400L,表明组织分布广泛。血浆蛋白结合率近90%。吉非替尼与血清白蛋白及αl—酸性糖蛋白结合。代谢体外研究数据表明参与吉非替尼氧化代谢的P450同工酶只有CYP3A4。体外研究显示吉非替尼可能有限的抑制CYP2D6酶。在一项临床试验中,吉非替尼与metoprolol(美多心安,一种CYP2D6酶底物)合用使该组的作用有少量的增高(35%),其实际临床意义尚未估计。
在动物实验中吉非替尼未显示酶诱导作用, 并且对其它的细胞色素P450酶也没有显著抑制作用(体外)。吉非替尼的代谢中三个生物转化的位点已被确定:N—丙基吗啉类的代谢,喹唑啉上甲氧取代基的脱甲基作用及卤化苯基类的氧化脱氟作用。在人血浆中分离到的主要代谢物是O-desmethyl 吉非替尼。它对EGFR刺激细胞生长的抑制作用比吉非替尼弱14倍,因此对吉非替尼的临床活性无明显作用。清除吉非替尼总的血浆廓清约为500mL/min。主要通过粪便排泄,约4%通过肾脏以原型和代谢物的形式清除。特殊人群:根据人群用药资料,没有发现稳态血药浓度与患者的年龄、体重、性别、种族或肌苷清除率之间有相关性。一项包括41例实体肿瘤伴有肝转移,而肝功能正常、中度或重度损害的患者的临床研究中对吉非替尼进行评价。
研究显示,口服吉非替尼每日剂量250mg 后,达到稳态时间、总的血浆清除率和稳态药物暴露水平(Cmaxss, AUC24ss)在肝功能正常组和中度损害组结果相似。从4例由于肝脏转移造成的严重肝功能不全的患者得到的数据提示稳态药物暴露水平亦与肝功能正常患者相似。没有在肝硬化或肝炎引起的肝功能损害患者中对进行研究。与处方者有关的临床前安全资料吉非替尼未显示基因毒性倾向。与吉非替尼的药理学活性相符合,当剂量给到20mg/kg/天时,可观察到鼠的生育能力减低。在器宫发生时期给高剂量(30mg/kg/天)时对鼠的胚胎发育无影响,但对于兔子,20mg/kg /天及以上的剂量则可减轻胎儿的重量。在两个物种间均未诱导出畸形。在鼠的妊娠及分娩期间给于20mg/kg/天的剂量可减少幼鼠的生存(见妊娠和哺乳节)。在鼠分娩后连续14天口服碳14标记的吉非替尼,乳汁中放射活性的浓度高于血液中的浓度(见妊娠和哺乳节)。非临床(体外)研究资料表明吉非替尼具有抑制心脏活动复极化过程(如QT间期)的可能性。其临床意义尚不知道。吉非替尼的致癌研究尚未进行。
用法用量推荐剂量为250mg(1片)每日1次,空腹或与食物同服。不推荐用于儿童或青少年,对于这一患者群的安全性和疗效尚未进行研究。不需要因患者的年龄,体重,性别或肾功能状况以及对因肿瘤肝脏转移引起的中度或重度肝功能不全的患者进行剂量调整。(参见“药物代谢动力学特性”部分)。
作用机制(1)竞争EGFR-TK催化区域上Mg-ATP结合位点,阻断其信号传递;
(2)抑制有丝分裂原活化蛋白激酶的活化,促进细胞凋亡;
(3)抑制肿瘤血管生成。Iressa已于2002年7月5日经日本厚生省批准用于治疗晚期NSCLC,2003年5月5日被FDA批准作为NSCLC的三线治疗药物,其推荐剂量为250mg,PO,qd。
值得提出的是,FDA这一决定是在Iressa刚完成II期临床试验,III期临床试验尚未完成的情况下批准的。2003年中国抗癌协会肺癌专业委员会对不能手术的NSCLC的治疗指引中提出:Iressa推荐用于治疗局部晚期或远处转移的非小细胞肺癌含铂类方案及Docetaxel化疗失败的病人。
不良反应最常见的药物不良反应( ADRs )为腹泻、皮疹、瘙痒、皮肤干燥和痤疮,发生率20%以上,一般见于服药后一个月内,通常是可逆性的。大约8%的患者出现严重的ADRs(CTC标准3或4级)。因ADRs停止治疗的患者仅有1%。可出现的ADRs总结如下:
非常常见(>10%)
消化系统: 皮肤及附件: 腹泻,主要为轻度(CTC1级),少有中度(CTC2级),个别报道严重腹泻伴脱水者(CTC3级)。恶心,主要为轻度(CTC1级)。 皮肤反应,主要为轻或中度(CTCl或2级)多泡状突起的皮疹,在红斑的基础上有时伴皮肤干燥发痒。
常见(>1-≤10%)
消化系统: 代谢和营养: 皮肤及附器: 全身: 眼科: 呕吐,主要为轻度或中度(CTC1或2级)。厌食,轻或中度(CTCl或2级)。口腔粘膜炎,多数轻微(CTC1级)。继发于腹泻、恶心、呕吐或厌食引起的脱水。 肝功能异常,主要包括无症状性轻或中度转氨酶升高(CTCl或2级)。 指甲毒性。脱发 乏力,多为轻度 (CTC1级) 结膜炎和睑炎,主要为轻度(CTC1级)。
不常见(>0.1-≤1%)
血液和淋巴: 眼科: 呼吸: 在服用华法令的一些患者中出现国际正常值(INR)升高及/或出血事件 角膜糜烂,可逆,有时伴异常睫毛生长。 间质性肺病,常较严重(CTC3-4)级,已有致死性病历的报道。
罕见 (>0.01-≤0.1%)
消化系统: 胰腺炎. 极罕见(




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国