对于特定的化学反应,反应级数(order of reaction)被定义为速率方程中各浓度项的幂次之和。反应级数由化学反应机理(reaction mechanism)决定,反应机理描述了反应的各瞬间阶段,这些瞬间反应会产生中间物,从而可以控制反应级数。反应级数在探讨反应机理的研究中有重要意义。
定义在化学反应的速率方程中,各物浓度项的指数之代数和就称为该反应的级数(order of reaction),用n表示。
反应速率方程可表示为:反应速率v速率等于速率常数k与反应物浓度的系数次方的乘积(与生成物无关)。
假设基元反应为: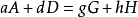
其数学表达式为: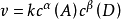
上式中:反应物浓度的次方为该反应物的反应级数或分级数,如反应物A的级数是α,反应物D的级数是β,各反应级数的加和α+β就为该反应的反应级数。反应级数越大,表示浓度对反应速率影响越大。1
性质一般而言,基元反应中反应物的级数与其计量系数一致;非基元反应则可能不同,其反应级数都是实验测定的,而且可能因实验条件改变而发生变化。例如,蔗糖的水解是二级反应,但是当反应体系中水的量很大时,反应前后体系中水的量可认为未改变,则此反应变现为一级反应。
在不同级数的速率方程中,速率常数k的单位不一样,一般为Ln-1·mol1-n·s-1,n为反应的反应级数。
基元反应和简单反应的反应级数n可以是整数一、二、三级(只有少数反应为三级),而复杂反应的反应级数n也可以是分数、负数和零级(光化反应、表面催化反应一般是零级)。负数级表示增加该物质的浓度反而使反应速率下降。但反应速率方程不具有简单的浓度乘积形式者,反应级数的概念就失去了意义。2
应用一级反应定义:凡是反应速率只与物质浓度的一次放成正比者,称为一级反应(first order reaction)。
五氧化二氮的分解反应:
 反应的速率方程为:
反应的速率方程为: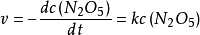
可以看出,此反应是一个一级反应。
对上式做定积分,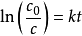 ,式中c0是初始浓度,c为反应到t时刻的浓度。
,式中c0是初始浓度,c为反应到t时刻的浓度。
由此可知,当反应物消耗一半时,有
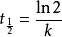 可以看出,一级反应的半衰期与反应的速率常数k成反比,而与反应物的起始浓度无关,这也是一级反应的一个特征。
可以看出,一级反应的半衰期与反应的速率常数k成反比,而与反应物的起始浓度无关,这也是一级反应的一个特征。
二级反应定义:反应速率和物质浓度的二次方成正比者,称为二级反应(second order reaction)。
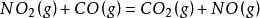
其速率方程: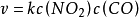
故对CO是1级反应;对NO2是1级反应;该反应为2级反应。2级反应k 的量纲:mol-1·dm3·s-1。
三级反应定义:反应速率和物质浓度的三次方成正比者,称为三级反应(third order reaction)。
三级反应为数不多,在气相反应中目前仅知有五个反应是属于三级反应,而且都与NO有关。这五个反应是:两个分子的NO和一个分子的Cl2,Br2,O2,H2,D2反应。即
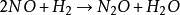

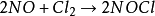
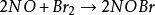
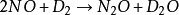
零级反应定义:反应速率与物质浓度无关者称为零级反应(zeroth order reaction)。
反应总级数为零的反应并不多,已知的零级反应中最多的是表面催化反应。例如,氨在金属钨上的分解反应:
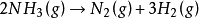
由于反应只在催化剂表面进行,反应速率只与表面状态有关。若金属表面已被吸附的NH3所饱和,再增加NH3的浓度对反应速率不再有影响,此时反应对NH3呈零级反应。
测定方法在测定反应级数的实验中,为了排除产物浓度的干扰,通常是测初速度。为了研究某一反应物浓度与反应速度的函数关系,常常将其他反应物的浓度固定后再确定该反应物的反应级数。
反应级数的测定方法包括两类:积分法和微分法,前者包括尝试法、作图法和半衰期法,后者又包括孤立法。下面介绍作图法和积分法两种:
关于微分法。将速率方程取对数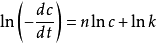 ,则
,则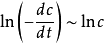 线性相关,斜率为n。具体步骤为,在曲线上取若干个浓度点,并作切线。计算每点处切线的斜率
线性相关,斜率为n。具体步骤为,在曲线上取若干个浓度点,并作切线。计算每点处切线的斜率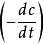 ,作
,作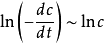 的图或线性回归求出n。
的图或线性回归求出n。
关于积分法。积分法是将c~t数据分别已知的动力学方程积分式中,如零级反应是c=c0-kt,一级反应是 ,二级反应
,二级反应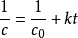 等,判断何者更合适,这种方法需要逐个尝试,计算量较大3。
等,判断何者更合适,这种方法需要逐个尝试,计算量较大3。
本词条内容贡献者为:
郑国忠 - 副教授 - 华北电力大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国