阿累尼乌斯方程又称为阿伦尼乌斯方程,是化学动力学的重要公式,由瑞典的阿伦尼乌斯所创立的化学反应速率常数随温度变化关系的经验公式。该公式具有三种不同的表达式,即:指数式、定积分式及微分式。
本方程不仅适用于所有基元反应,而且对于复杂反应中的任一基元反应也是适用的。1
提出阿伦尼乌斯方程是瑞典化学家阿伦尼乌斯于1889年,总结了大量实验结果的基础上,提出的关于化学反应速率常数与温度之间的关系式。
形式微分形式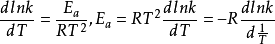
k—温度T时的反应速度常数,min-1;
Ea—反应活化能,一般视为与温度无关的常数,J·mol-1或·kJ·mol-1;
T—绝对温度,K;
R—摩尔气体常数,8.314J/mol·K。
定积分形式对微分形式的阿伦尼乌斯方程做不定积分,可得
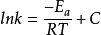 由上式可以看出,以lnk对1/T作图应为一条直线,其斜率为-Ea/R。对于大多数化学反应,都有这样的关系式。若温度分别为T1和T2时,反应速率常数分别为k1和k2,则
由上式可以看出,以lnk对1/T作图应为一条直线,其斜率为-Ea/R。对于大多数化学反应,都有这样的关系式。若温度分别为T1和T2时,反应速率常数分别为k1和k2,则
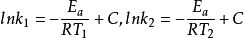 两式相减得:
两式相减得:
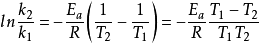
利用换底公式,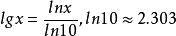 ,将ln换算成lg得:
,将ln换算成lg得: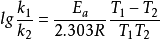
指数形式阿伦尼乌斯公式还可以引入一个指前因子A(preexponential factor,也称频率因子)。
令C=lnA得:
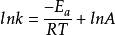
两边取指数改写成:
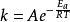
其中,A—指前因子,也称为频率因子或阿伦尼乌斯常数,min-1;
这个式子表明反应速率常数与温度呈指数关系。因此,人们将此式称为反应速率随温度而变的指数定律。2
适用性化学反应的类型是比较多的,温度对反应速率的影响也是相当复杂的,并非所有的化学反应都符合Arrhenius经验公式。但对于最常见的简单反应来说,化学反应速率通常随温度的升高而加快,而且成指数关系,可以用Arrhenius公式来定量描述。
本公式虽然最初是从气相反应中总结出来的,但同样适用于液相反应和复相催化反应。
另外,本公式不仅适用于基元反应,而且对于复杂反应中的任一基元反应也是适用的。
同时,对于某些复杂反应来说,只要其速率公式满足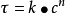 ,(或
,(或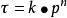 ) 的形式,仍可以运用本公式来描述k与T的关系,只不过此时公式中指数前因子和活化能已不再具有简单反应那样明确的意义,而可能是组成该复杂反应的各个简单反应的指前因子或活化能的某种组合。3
) 的形式,仍可以运用本公式来描述k与T的关系,只不过此时公式中指数前因子和活化能已不再具有简单反应那样明确的意义,而可能是组成该复杂反应的各个简单反应的指前因子或活化能的某种组合。3
精确性从定量角度来看,阿氏公式并不是完全精确的。因为公式中关于指数前因子和活化能与温度无关的假设是不严格的, 以致于以lnk对1/T带作图所得直线常显示不同程度的弯曲。
首先, 指前因子A是与温度有关的。从理论上讲, 无论是碰撞理论还是过渡态理论,都推导出A是与T有关的;从实践来看,用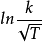 (或
(或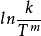 ) 对条作图,的确能得到更好的直线。为此不少作者(如Hyne、World和Adams等)从公式的对数式出发进行温度修正, 使得公式的图线有了不同程度的改善。1
) 对条作图,的确能得到更好的直线。为此不少作者(如Hyne、World和Adams等)从公式的对数式出发进行温度修正, 使得公式的图线有了不同程度的改善。1
同时, 从活化能的定义来看,由于其来源和物理意义不同,其表达式也各不相同,有的与温度无关, 有的则与温度有关。4一般地,当把活化能定义为反应物分子间要发生反应所应达到的临界能量时,这种活化能可以认为是与温度无关的;而当活化能定义为某个反应发生所需的临界能量与反应物分子平均能量之差时,这种活化能必定与温度有关。这是因为临界能量可能与温度无关,而分子的平均能量却与温度有关。
从上面可以看出,Arrhenius公式中关于A 和Ea与温度无关的假设是近似的。
本词条内容贡献者为:
郑国忠 - 副教授 - 华北电力大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国