卢卡斯试剂(英语:Lucas' reagent)是无水氯化锌溶于高浓度盐酸所配制成的一种溶液。这种溶液被用于鉴别区分低分子量的醇。反应中氯会取代短链醇中的羟基,生成不溶于水的氯代烷,呈现沉淀。自从1930年被霍华德·卢卡斯报导以来,这个测试方法已经成为标准的鉴别方法。
简介卢卡斯试剂又称盐酸—氯化锌试剂,适用于3一6个碳原子的伯 、仲、叔醇的特征鉴别。在温水浴中试剂与叔醇,立 即反应、发热并产生卤代烃油状物,该油状物不溶于反应试剂而呈浑浊并分层。在温水浴中试剂与仲醇反应稍慢,需几分钟时间,呈浑浊而分层,发热不明显;而试剂与伯醇在常温下几小时也难分层 。利用上 述反应速度的不同,卢卡斯试剂作为实验室区别伯、仲、叔醇的一种试剂 。
在有机分析中用作伯、仲、叔醇的鉴别试剂。叔醇或苄醇与该试剂混合后,溶液立即浑浊或分层:5~10min内分层的为仲醇,不分层的为伯醇。1
制备传统方法将无水氯化锌在蒸发皿中加热熔融,稍冷后在干燥器中冷至室温,取出捣碎,称取136g溶于90ml浓盐酸中 (溶解时有大量气体和热量放出)冷却后贮于试剂瓶中,塞紧瓶塞,备用 。
此法配制的卢卡斯试剂稳定性较差,放置时间短,使用时要求临时配制,实验效果不稳定,现象不明显、且配置方法复杂。
改进称取5g锌粒,先用HCl 5ml按1:1 洗涤去掉氧化物,然后用干净滤纸条吸干。将锌粒放人200ml 烧杯中 ,把烧杯放在通风橱内用量筒量取40ml 浓HCl于烧杯 中,此时锌粒溶解并有大量气体和热量放出,溶解完全后,稍冷却转人200ml 试剂 瓶中,再加人60ml 浓 HCI ,塞紧瓶塞即得到盐酸氯化锌试剂 。
实验方法在3支大试管中分别加上述改进方法配制的试剂各1ml,然后在各试管中分别加人正丁醇、仲丁醇、叔丁醇各 5 滴,振荡。放在温水浴中加热,观察试管内溶液变浑浊的时间 。叔丁醇加人卢卡斯试剂后振荡,2min内即变浑浊, 静置后分层。仲醇加人卢卡斯试剂后,在温水浴中加热数分钟后,振荡试管静置,溶液慢慢出现浑浊, 然后分层,而正丁醇在加热的情况1h也不分层。
将上述配制的卢卡斯试剂放置一段时间后,再进行稳定性实验。通过试验,试剂放置20d左右仍然较稳定,能与叔丁醇在2min之内出现浑浊并分层;在温水浴能与仲丁醇在10min之内出现浑浊并分层,而滴入正丁醇不出现浑浊和分层。
试验失败原因1、卢卡斯试剂不够灵敏:醇与卢卡斯试剂反应是单分子亲核取代反应机理,可表示如下:
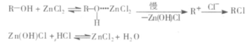
由此可以看出,HCl和ZnCl2都参与了反应过程,试剂中ZnCl2和HCl的浓度是决定反应速率的重要因素。
ZnCl2和 浓 盐 酸不但要有恰当的配比,还应该具有足够高的浓度,试剂才会具有足够高的 灵敏度。
2、生成的低级氯代烃易挥发
卢卡斯试验生成的低级氯代烃的沸点比较低,相对密度都低于卢卡斯试剂。以正丁基氯、仲丁基氯和叔丁基氯为例,它们的沸点和相对密度如下表:
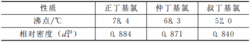
可见卢卡斯试验中生成的低级氯代烃是容易挥发散失的。由于仲醇反应较慢,伯醇反应更慢,氯代烷烃一边生成一边挥发,所以不容易形成显著的浑浊或分层现象;实验中发现,即使是反应最快的叔醇,原先出现的浑浊或分层现象时间稍长也会消失。因此生成的氯代烃挥发散失也是导致卢卡斯试验失败的原因之一。
卢卡斯测试卢卡斯测试基于伯醇、仲醇和叔醇和氯化氢反应速率的不同:
ROH + HCl → RCl + H2O
等物质的量的ZnCl2和盐酸组成了卢卡斯试剂,在盐酸的作用下,醇中的羟基发生质子化,脱去一分子水形成碳正离子,碳正离子和氯离子结合生成氯代烷。反应的快慢和醇对应的碳正离子稳定性有关,由于烃基的推电子性,叔碳正离子最稳定,容易生成,而伯碳正离子最不稳定,难以生成,所以可以通过反应的快慢判断低级醇的结构。
各类醇与卢卡斯试剂的反应速率:苯甲型醇,烯丙型醇,叔醇>仲醇>伯醇:
无可见反应,溶液不变浑浊,原物质为伯醇。
溶液在5到10分钟之内变为云雾状,原物质为仲醇。
溶液立即变成云雾状,发生相分离,原物质为叔醇。
此外,由于p-π共轭,苯甲型醇、烯丙型醇也很容易形成碳正离子而与卢卡斯试剂迅速反应。低级一元醇且是六个碳以下的醇,在反应中卢卡斯试剂与醇发生取代反应。
本词条内容贡献者为:
江长胜 - 教授、博导 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国