质子理论阐述,能给出质子的分子或离子是酸,能接受质子的分子或离子是碱,酸给出质子转变为相应的碱,碱接受质子转变为相应的酸,这种因质子得失而相互转变的一对酸碱称为共轭酸碱对。1
酸碱质子理论根据布朗斯特德和劳莱的酸碱质子理论, 认为酸是能给出质子的物质, 碱是能接受质子的物质。酸失去质子, 变成该酸的共扼碱碱得到质子后变成该碱的共扼酸, 有这种关系的酸碱称共扼酸碱对。根据酸碱的质子理论, 酸或碱可以是中性分子, 也可以是阳离子或阴离子。既有酸的性质又有碱的性质的物质称为两性物质, 同理, 具有酸的性质又有碱的性质的溶剂为两性溶剂。酸或碱的失去质子或得到质子总是在某种溶剂中进行的,而两性溶剂分子之间本身就能发生质子的转移反应, 即质子自递作用。2
共轭酸碱对定义共轭酸碱对是一对以质子得失关系联系起来的酸和碱。根据酸碱质子理论,酸和碱总是对应存在,酸给出质子变成其共轭碱,而碱得到质子变成其相应的共轭酸,这种关系叫共轭关系。如醋酸(HAc)和醋酸根(Ac)、氨 (NH3)和铵离子(NH4)等均为共轭酸碱对。在分析化学中,这种共轭体系常被作为酸碱缓冲体系,即保持分析溶液为一定的pH值,不受外界少量的酸或碱的加入以及溶液稀释的影响。3
共轭酸碱对与缓冲溶液与电离理论最大的不同在于,质子理论里面只有酸碱的概念,而没有盐的概念。因此,在缓冲溶液中,缓冲对即为一对共轭酸碱对。实际上应用共轭酸碱对的概念,缓冲溶液可以只分成两类,即弱酸及其共轭碱和弱碱及其共轭酸两类。此外,在高浓度的强酸强碱溶液中,由于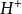 或
或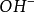 的浓度本来就很高,外加少量酸或碱不会对溶液的酸度产生太大的影响,在这种情况下,强酸强碱也是缓冲溶液,它们主要是高酸度(pH12)时的缓冲溶液。1
的浓度本来就很高,外加少量酸或碱不会对溶液的酸度产生太大的影响,在这种情况下,强酸强碱也是缓冲溶液,它们主要是高酸度(pH12)时的缓冲溶液。1
共轭酸碱对在缓冲原理中的应用以HB—B—缓冲溶液体系为例,HB和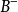 的起始浓度很大,体系中存在共轭酸HB和它的共轭碱。根据酸碱反应的原则,不难知道,如果向此溶液中加入少量强酸时,溶液中的共轭碱可以接受
的起始浓度很大,体系中存在共轭酸HB和它的共轭碱。根据酸碱反应的原则,不难知道,如果向此溶液中加入少量强酸时,溶液中的共轭碱可以接受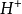 ,生成HB,从而抵抗
,生成HB,从而抵抗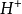 对pH的影响。如果向此溶液中加入少量强碱时,溶液中的共轭酸HB可以接受
对pH的影响。如果向此溶液中加入少量强碱时,溶液中的共轭酸HB可以接受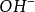 ,生成
,生成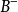 ,从而抵抗
,从而抵抗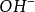 对pH的影响。因为共轭酸碱对的存在,所以可以抵抗少量外加酸碱,从而保持缓冲溶液的pH值基本不变。1
对pH的影响。因为共轭酸碱对的存在,所以可以抵抗少量外加酸碱,从而保持缓冲溶液的pH值基本不变。1
共轭酸碱对在缓冲溶液pH值计算公式中的应用以质子理论来看,由共轭酸和共轭碱组成的缓冲溶液是最普遍和最典型的,应用共轭酸碱对的概念,我们可得到公式: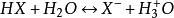
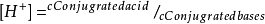 进而通过就算可知:
进而通过就算可知:
该式也可以表示为: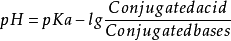
其中,pKa是共轭酸的酸常数。用计算式可以计算共轭酸及其共轭碱组成的缓冲溶液质子浓度(pH)。1
共轭酸碱对在缓冲范围表述中的应用理论研究表明,缓冲溶液超出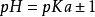 (弱酸及其共轭碱,或者弱酸及其对应的盐)或者
(弱酸及其共轭碱,或者弱酸及其对应的盐)或者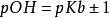 (弱碱及其共轭酸,或者弱碱及其及其对应的盐)就不再具有缓冲能力。应用共轭酸碱对的概念,缓冲范围可以仅仅以
(弱碱及其共轭酸,或者弱碱及其及其对应的盐)就不再具有缓冲能力。应用共轭酸碱对的概念,缓冲范围可以仅仅以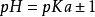 或
或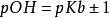 表示,示例见表二。1
表示,示例见表二。1

共轭酸碱对在缓冲对选择中的应用实际工作中需要制备某一pH值的缓冲溶液时,可按下列步骤进行:
按照电离理论,选择一种缓冲对,使其中弱酸(或弱碱)的pKa(或pKb)与所需要的pH(或pOH)相等或相近,如pKa或(pKb)与所需要的pH(或pOH)值不完全相等时,则按所要求的pH(或pOH)值,利用缓冲方程式,计算出所需的弱酸(或弱碱)和盐的浓度比。按照质子理论,仅仅将“盐”换成“共轭碱”(或“共轭酸”)而已。1
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国